

毕赤酵母(Pichia pastoris)是第二代酵母表达系统中的代表性菌株,是美国FDA认定的GRAS(Generally Recognized As Safe)微生物,具有表达水平高,产物活性好,培养成本低,易扩大为工业化生产等特点。在生物制药领域,抗菌肽、酶制剂、胰岛素、表皮生长因子、胶原蛋白、人乳头瘤病毒疫苗等多种生物制剂已经通过毕赤酵母系统进行商业化生产。与其他产品杂质一样,毕赤酵母宿主残留蛋白(HCP)可能对生物制品的安全性和有效性产生不利影响,因此在生产监测、产品放行等过程中需要对其进行定量研究并进行严格控制。
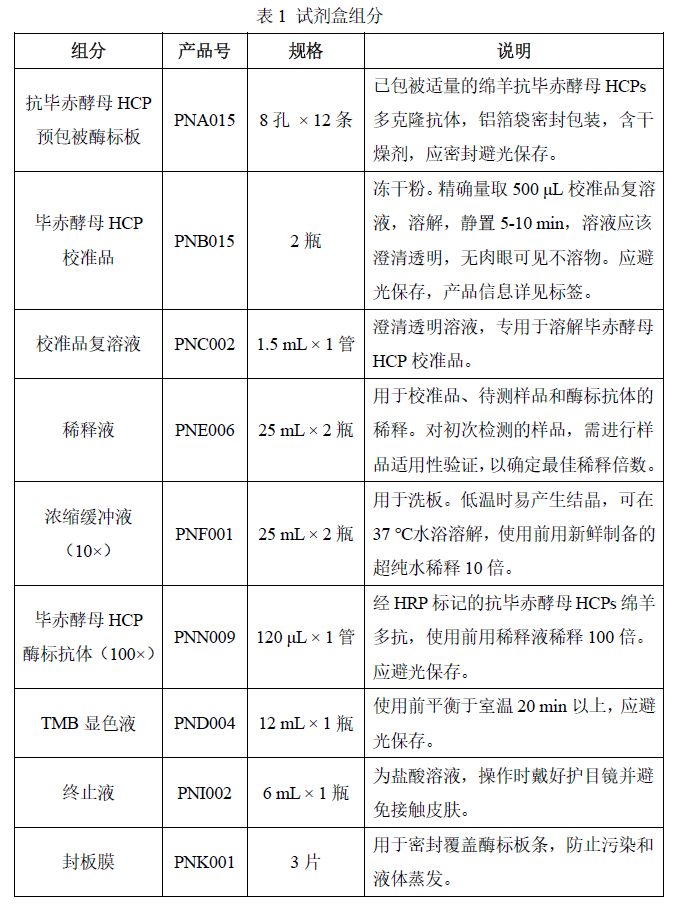
SHENTEK®毕赤酵母HCP残留检测试剂盒(一步酶联免疫吸附法)是湖州申科自主研发、具有完全自主知识产权的、实现关键试剂全国产化的毕赤酵母HCP通用检测试剂盒。本试剂盒适用于基于GS115、X33等在内的毕赤酵母菌株生产的生物制品中宿主残留蛋白的定量检测,操作步骤少、快速,检测专一性强,性能稳定可靠。
产品信息:
• 类型:ELISA(板式)
• 规格:96测试
• 检测时间:3.5小时
• 定量范围:2-200 ng/mL
• 定量下限(LLOQ):2 ng/mL
• 检测限(LOD):0.5 ng/mL
• 专属性:对毕赤酵母常见菌株(GS115、X33等)具有很好的定量准确性;与常见表达宿主,如E.coli、CHO、Sf9等宿主蛋白无明显交叉反应;对于酵母其他种属(酿酒酵母、汉逊酵母等)的交叉反应率低于1%。
• 抗体覆盖率:72.1%-96.0%(IMBS-2D),99.2%(IMBS-MS,Unique Peptide≥2)
• 定量校准品的广谱性:二维电泳银染条件下可识别1139个蛋白点(2D-PAGE),具有广泛代表性。
产品特点:• 操作简单:一步加样、一步洗涤,全过程室温下即可完成。
• 灵敏度高:检测限低至0.5 ng/mL,满足实际检测需求。
• 兼容性好:全流程可适配SHENTEK®全自动ELISA分析系统等自动化平台。
• 质量可控:试剂盒按照药典、法规完成各项检测指标的性能验证。
• 适配简单:客户仅需通过适用性验证即可进行样品测试与结果报告。
• 灵活性高:针对复杂样品和特殊需求,可进行半定制化或定制化测试与开发。
质量保证:
• 关键原料储备充足,降低换批风险。
• 建立ISO13485质量管理体系,涵盖产品研发、生产、交付、售后的全生命周期管理。
• 生产高度设备化,历史多批次生产稳定,供应链完善。
• 专业高效的质量团队,拥有丰富的质量分析经验。
n 产品名称
毕赤酵母 HCP 残留检测试剂盒(一步酶联免疫吸附法)
n 包装规格
96 测试/盒。
毕赤酵母 HCP 残留检测试剂盒(一步酶联免疫吸附法)适用于基于 GS115、X33 等在内的毕赤酵母(拉丁文名:Pichia pastoris)菌株生产的生物制品中宿主残留蛋白的定量检测。
该试剂盒仅供研究使用,不可用于诊断。
本试剂盒基于固相酶联免疫吸附分析法( Enzyme-linked Immunosorbent Assay, ELISA),采用双抗体夹心的方式对待测样品中毕赤酵母残留 HCPs 进行定量检测。
该分析方法通过在预包被抗毕赤酵母 HCPs 绵羊多抗的酶标板中加入校准品或待测样品、HRP 标记的抗毕赤酵母 HCPs 绵羊多抗进行共孵育;洗涤后,加入 TMB 底物进行显色反应,最后使用终止液终止酶催化反应。利用酶标仪在 450 nm 波长下测读吸光度,其吸光度与校准品或待测样品中的 HCPs 浓度成正相关,通过校准品拟合的剂量-反应曲线即可计算得出待测样品中毕赤酵母 HCPs 的浓度。
本试剂盒对待测样品无需进行特殊处理,仅需通过合适的稀释比例进行适用性验证即可直接使用。本试剂盒操作步骤少,快速,检测专一性强,性能稳定可靠。
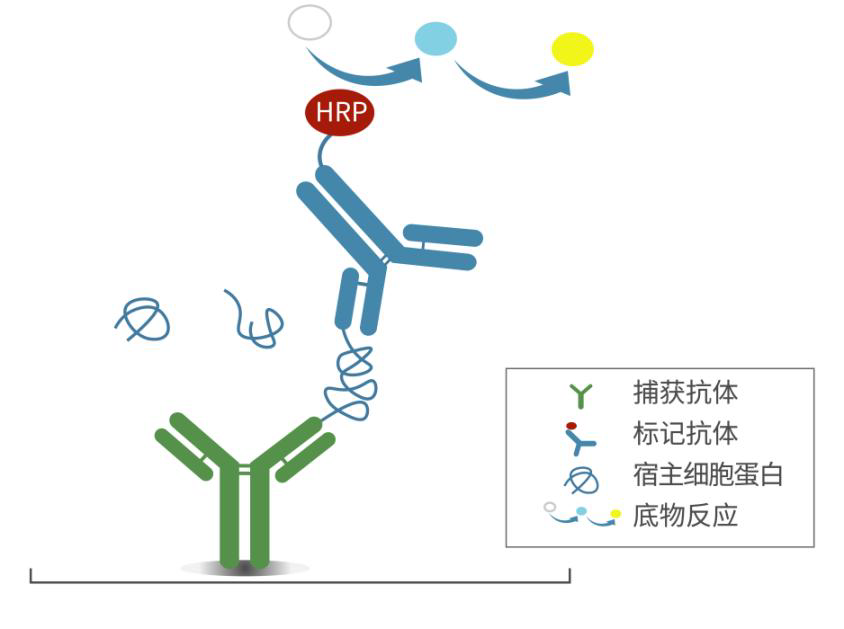
图 1 检测原理示意图
未开封试剂盒置 2-8 ℃保存,有效期为 12 个月。开封组分的保存要求如下:

1. 稀释用无菌离心管
2. 移液器配套用枪头
3. 拍干酶标板用吸水纸
4. 加样槽
1. 酶标仪(能够检测 450 nm 和 620-650 nm 区间内单一波长的吸光度值)
2. 单道或多道的微量移液器
3. 微孔板恒温振荡器
4. 恒温箱(可选)
5. 洗板机(可选)
n 实验操作流程
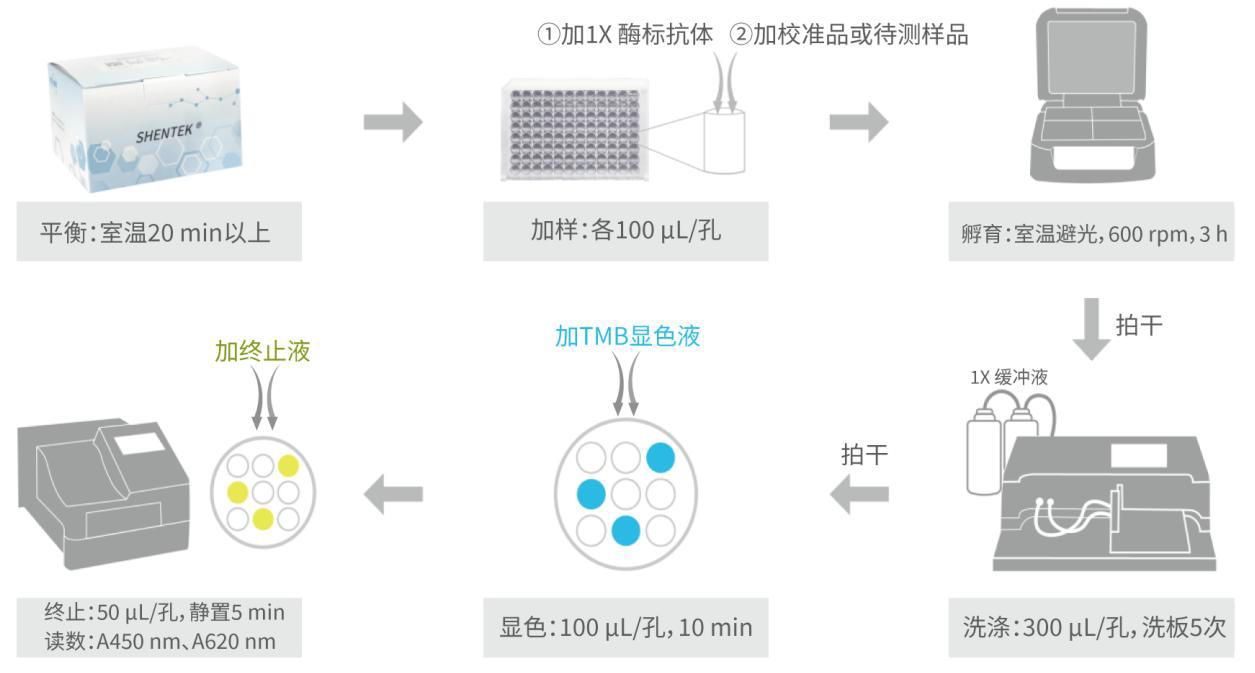
图 2 操作流程示意图
1. 取出预包被酶标板,于室温平衡约 20 min。其余试剂在使用前均需提前取出,于室温平衡;在使用后立即放回 2-8 ℃保存。
2. 根据检测样品数量计算所需孔数,取出相应数量的预包被酶标板条,剩余板条连同干燥剂置于自封袋中密封,放回试剂盒中,保存在 2-8 ℃冰箱,于效期内使用完。
备注:酶标板部分孔壁可能会有结晶,属正常现象,无需特殊处理。备注:室温指 25 ℃ ± 3 ℃。
1. 毕赤酵母 HCP 校准品溶解:精确量取校准品复溶液 500 μL,加入西林瓶中,轻柔颠倒混匀,静置 5-10 min,得到复溶校准品。
备注:根据标签信息计算复溶校准品浓度后再进行梯度稀释。若需同时使用多瓶校准品,请分别溶解后转移、合并至 1.5 mL 无菌离心管,振荡混匀后使用。
2. 1×缓冲液配制:浓缩缓冲液(10×)用超纯水稀释 10 倍,例如取 25 mL 浓缩缓冲液(10×)加入 225 mL 超纯水混匀,即为 1×缓冲液,用于洗板。建议现配现用。若因采用洗板机洗涤而导致 1×缓冲液试剂量不足,可单独采购相同产品号的缓冲液。
备注:取出浓缩缓冲液(10×)和稀释液观察,如有结晶属正常现象,于37 ℃温育直至完全溶解。
3. 检测抗体配制:用稀释液于无菌离心管中将其稀释 100 倍,轻轻颠倒混匀,即为 1×毕赤酵母 HCP 酶标抗体。配制合适体积,以保证加液时有充足的余量。现配现用。
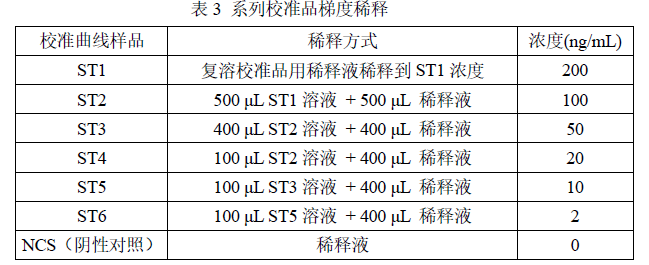
4. 校准曲线配制:参照图 3 和表 3 对校准品进行梯度稀释。
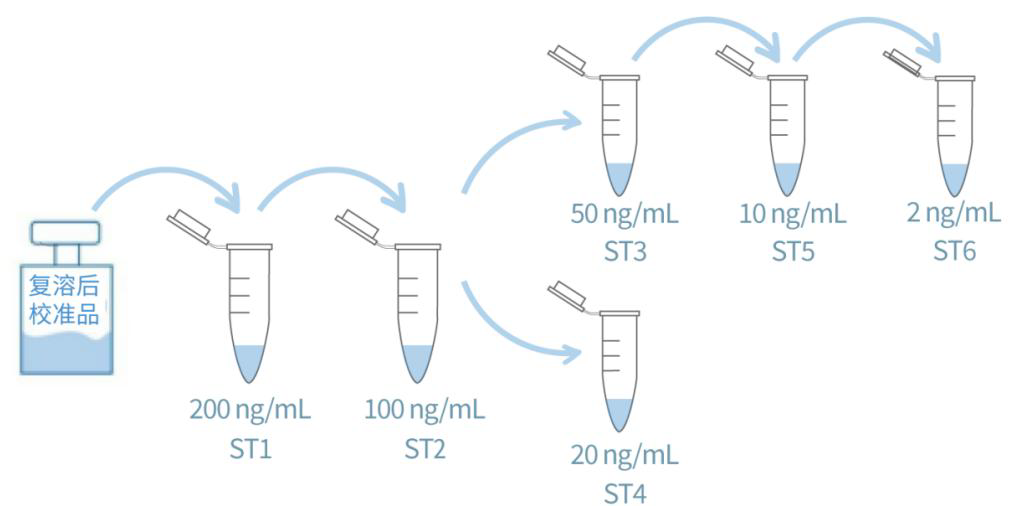
图 3 校准品稀释操作示例
二、样品准备
样品:包括上游表达、下游纯化过程样品及原液、成品制剂等。样品应清澈透明,经离心或过滤等方式去除不溶物。
处理:待测样品根据其预估所含的 HCPs 浓度,用稀释液稀释适当倍数,使其检测值落入校准曲线定量范围之中。建议样品稀释倍数选择 10 倍以上,保证稀释液发挥正常效应。
对初次使用或样品 HCPs 含量未知的情况,强烈建议进行样品适用性验证,确定适宜的样品稀释倍数,以便更好地进行后续常规检测。
备注:相关验证方案可咨询我司技术支持。
1. 加入检测抗体:取 1×毕赤酵母 HCP 酶标抗体溶液到加样槽中,用多通道移液器快速将抗体溶液 100 μL/孔加入微孔板孔底部,勿引入气泡。实际检测时可根据样品数量加样(可参考表 4 示例进行 96 孔板排版)。
2. 加入校准品和待测样品:准确移取 100 μL 系列校准品溶液、稀释液(0值)、待测样品加入相应微孔板中。每个浓度建议做 2-3 个平行复孔,并记录各浓度孔所在位置。
3. 加样完毕后将微孔板用封板膜密封,放置于微孔板恒温振荡器上,室温条件下 600 rpm,避光振荡孵育 3 h。
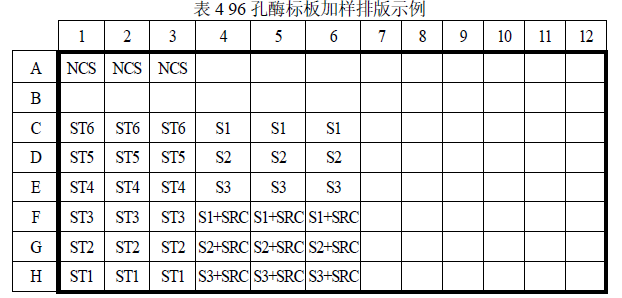
² 该示例表示的是检测 6 个浓度梯度的校准曲线(ST1-ST6)、1 个阴性对照( NCS ) 、 3 个待测样品( S1-S3 ) 和每个样品的加标回收(S1+SRC-S3+SRC)。
² 实际检测时可根据样品多少,参照此示例进行 96 孔板排版加样。
² 客户可根据方法验证结果确定日常检测复孔数及是否设置加标回收。
1. 提前 20 min 将 TMB 显色液置于室温条件下平衡。
2. 将上述板子用 1×缓冲液洗板,300 μL/孔,迅速甩掉液体,于纸巾上拍干如此重复洗板 5 次。洗板后的微孔板应立即进行后续操作,不可放置。
3. 取合适体积的 TMB 显色液于加样槽中,用多通道移液器迅速将 TMB 显色液 100 μL/孔加入上述微孔板中,于室温避光温育 10 min。此步骤勿用封板膜密封。
1. 取合适体积的终止液于加样槽中,用多通道移液器迅速将终止液 50 μL/
孔加入上述微孔板中。
2. 终止后的微孔板于室温放置 5 min。
1. 设定酶标仪波长 450 nm 和 620-650 nm(620-650 nm 区间内单一波长均可),测定各孔 OD 值。测定时不可覆盖封板膜或盖子。
1. 各孔 OD450 nm 数值需减去各自孔的长波长 OD 值。若酶标仪没有配备长波长时,可以省去此步骤。
2. 各校准点和样品的 OD 值分别减去阴性对照(NCS)的 OD 值后,重复孔取均值。
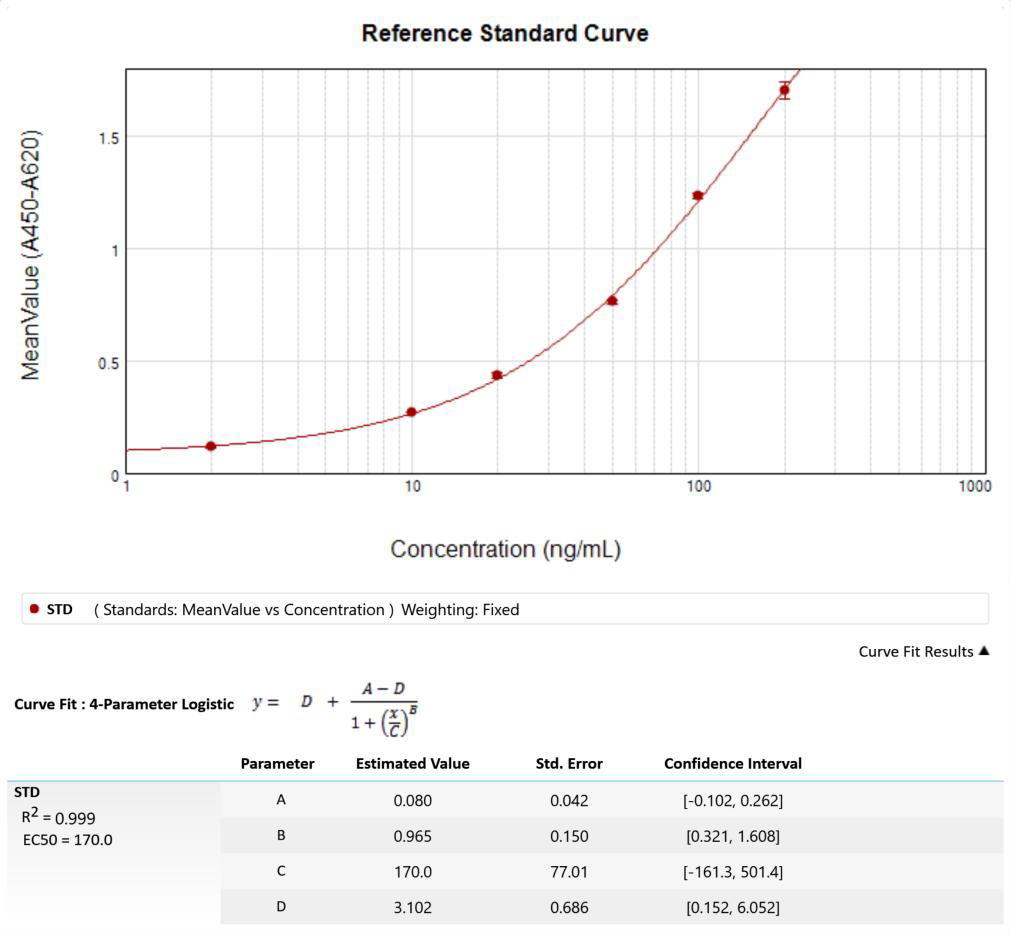
3. 分别以校准点浓度值和经步骤(2)处理后的 OD 均值作为 X 轴和 Y 轴参数进行曲线拟合(共 6 个点),获得校准曲线方程。建议优先采用四参数拟合。校准曲线的拟合可以使用酶标仪自带的软件。如无,则建议采用专业的校准曲线拟合软件,如 Curve Expert,ELISA Calc 等。
4. 将样品的 OD 均值作为 Y 值代入步骤(3)获得的方程,回算 X 值计算样品浓度。若样品是经过稀释后进行测试的,则样品终浓度=稀释后测定值×稀释倍数。
1. 校准曲线性能:典型校准曲线参数见(四)所述。校准曲线可能因实验人员的差异和环境的变化而有所差别,为正常现象。
2. 样品适用性:根据多个稀释倍数下的样品结果及其在对应稀释倍数下的适宜加标样品计算回收率,并评估其稀释线性,应符合相应法规的方法学验证要求。
3. 样品报告结果:对同一样品采用多个稀释倍数进行测试,样品结果采用符合样品适用性的多个稀释倍数下回算的均值。
1. 本品仅适用于研究用途,不用于临床诊断。
2. 过低或过高的样品溶液 pH 值可能会超出稀释液的缓冲范围,从而影响试剂盒的性能,建议控制样品溶液的 pH 在 6.5-8.5 之间。
3. 样品基质及制剂的组分不应是由毕赤酵母表达的产物,否则可能会由于组分中毕赤酵母 HCP 的残留而造成样品定量异常。
4. 若样品中主产品具有蛋白酶活性的,可能会因酶降解作用而造成样品定量异常。建议通过合适方式对主产品灭活后进行测试。
1. 线性范围:2-200 ng/mL,线性相关系数 R2≥0.990。
2. 最低定量限 LLOQ:2 ng/mL。
3. 特异性:与常见外源表达系统宿主,如原核表达宿主 E.coli、真核表达宿主 CHO、昆虫表达宿主 Sf9 等宿主蛋白无明显交叉反应;与酿酒酵母、汉逊酵母的交叉反应率低于 1%。
4. 典型校准曲线及其参数
试剂盒使用人员需经过培训,合格后方可使用。为了获得满意的检测结果,请您务必事先留意如下几点事项:
² 所有的试剂配制务必使用无菌一次性的吸头、试管和加样槽等,切勿混用。避免微量移液器吸头连接部分的污染,建议每次实验前后用 75 %酒精擦拭。规范移液操作,严禁液体倒吸到移液器,或未去掉吸头时横放在桌上。
² 校准品和样品的稀释混匀要轻柔充分,勿产生大量泡沫。
² 终止液为酸性溶液,在使用中注意眼睛、面部、手和衣服的防护。
² 不同批次试剂盒不建议混用。
² 配制缓冲液所用水需为无菌水或新鲜制备的超纯水,水温不得超过 37 ℃。
² 加样时将样品加于酶标板底部,尽量不接触孔壁。注意不要有气泡,可轻轻晃动混匀。在上机检测前若有气泡存在,需用干净的 10 μL 吸头或针头等戳破,注意不要吸走孔内液体,导致结果误差大。
² 在孵育反应时需给酶标板覆膜,防止样品蒸发。
² 倒去缓冲液后应马上加后续溶液,勿让酶标孔处于干燥状态,以防影响试剂盒检测性能。
² 不用的酶标板条需用试剂盒附带的自封铝箔袋避光保存,以免被其他样品污染,导致试剂盒报废。
² 校准品配制、样品稀释等务必精确,配制时最小的取样量不要小于 5 μL,防止结果出现较大的误差。
² 毕赤酵母 HCP 酶标抗体(100×)请在使用前快速离心,将管盖中残留的试剂甩到管底,防止试剂的污染和损失。
² 已稀释到工作浓度的校准品、1×毕赤酵母 HCP 酶标抗体等因无法保证其稳定性,不建议再次重复使用。
² 显色液应是无色透明液体。吸取时务必更换干净的吸头,防止 HRP 污染。如发现已有淡蓝色,请弃用。
² 确保加入终止液后 5-10 min 再上机检测,结果更稳定,时间不超过 30 min。
² 由于叠氮钠能抑制 HRP 活性,对检测结果有很大影响,因此样品中不能添加叠氮钠。
若实验结果出现异常,请及时对未使用的酶标板和试剂进行妥善保管,对显色的酶标板实验结果拍照,保留实验原始数据。联系我司技术支持为您解决问题。
以下常见的异常现象及解决方法供您参考。
问题描述 | 可能原因 | 解决方法 |
1. 共耗污染,如试剂、仪器、环境等; | 1. 共耗试剂应现用现配,共耗仪器使用前后应及时清洁; 2. 校准品复溶、稀释应规范,瓶(管)口切勿触碰移液器外壁,造成管间交叉污染; 3. 手动洗板时移液器吸头应悬空,切勿触及管内液面; 4. 严格按照说明书推荐的加液量、洗板次数和浸泡时间,切勿随意更改; 5. 毕赤酵母 HCP 酶标抗体(100×)使用时未 稀释 100 倍或稀释错误。 | |
2. 毕赤酵母 HCP 校准品复溶、稀 释过程中造成污染; | ||
背景信号高 | 3. 洗板操作不规范,如洗板次数不够,加液量不足,浸泡时间 | |
不足; | ||
4. 试剂错配。 | ||
1. 试剂过期; 2. 实验过程未严格按照说明书进行。 | 1. 确认试剂盒及其各组分在有效期内,若已 | |
过期,请联系销售/采购部门更换; | ||
2. 实验前需对实验人员进行实操培训,保证 | ||
实验顺利; | ||
实验结果与 参考性能参数相差较大 | 3. 对实验关键步骤,如使用浓度、加样量、 孵育时间等需进行严格控制,不可以经验 | |
值判断替代说明书; | ||
4. 强烈建议购买毕赤酵母HCP 质控品对实验 | ||
过程进行监控,如有需求可联系我司销售 | ||
部门。 | ||
1. 进行回顾性审查或进行验证实验,确认各 | ||
试剂加样量准确、均一; | ||
复孔间平行性较差 |
1. 移液失误; 2. 移液枪精度差; 3. 边缘孔效应引起的不均一性。 | 2. 对移液设备进行定期校准和测试; 3. 更换布局方式,或避免使用边缘孔保证实验的准确性; 4. 强烈建议对各样品做三重复以上。若同一 |
样品出现异常值,可采用适合的异常值剔 | ||
除方法去除异常值后进行数据处理。 |
l 《中国药典》9012 生物样品定量分析方法验证指导原则
l 《 美 国 药 典 》 <1132>章 节 , “Residual Host Cell Protein Measurement in Biopharmaceuticals”。
l 《欧洲药典》2.6.34 章节, “HOST-CELL PROTEIN ASSAYS”。
l YY/T 1183-2010 酶联免疫吸附法检测试剂(盒)。
修订日期:2024 年 07 月 15 日
生效日期:2024 年 07 月 23 日




