

本试剂盒适用于生物制品(单抗、融合蛋白等)中HCP的富集和去高丰度蛋白。
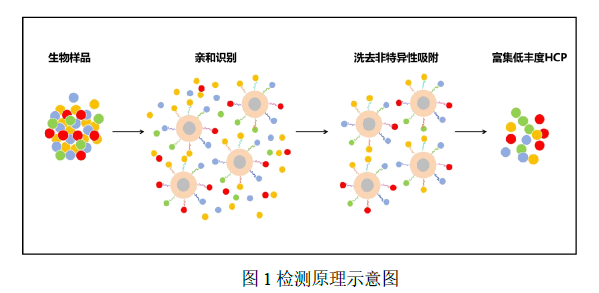
本试剂盒利用磁珠法构建了一个多样化且复杂的亲和配体库,旨在高效地识别并结合目标蛋白。其设计不仅针对传统的单一蛋白,还能适用于融合蛋白、单克隆抗体等多种生物样本类型,展现了卓越的适用性和灵活性。
5 mL(10 mg/mL)
低丰度宿主残留蛋白(Host Cell Protein, HCP)富集试剂盒,专为生物制品(如单抗、融合蛋白等)中 HCP 的富集和去除高丰度蛋白而设计。该试剂盒处理富集后的 HCP 样品可用于电泳分析,也能够与质谱表征兼容。
该试剂盒仅供研究使用,不可用于诊断。
在生物制剂的生产过程中,HCP 是由宿主细胞(通常是哺乳动物细胞或微生物)产生的蛋白质。这些蛋白质具有潜在的风险,可能会影响药物的安全性和有效性。因此,对 HCP 监测是生物药物生产中一个关键质量属性,它要求在药物的开发和生产阶段对 HCP 的存在进行严格的监控、管理和记录。
随着生产流程,生物制品的纯度逐渐提高,相应地,HCP 的含量也在持续降低。这使得对 HCP 的分析和监测工作变得更加具有挑战性。在这种情况下,开发高效的 HCP富集材料和技术变得尤为关键。
本试剂盒利用磁珠法构建了一个多样化且复杂的亲和配体库,旨在高效地识别并结合目标蛋白。其设计不仅针对传统的单一蛋白,还能适用于融合蛋白、单克隆抗体等多种生物样本类型,展现了卓越的适用性和灵活性。由于磁性纳米颗粒的独特性质,本试剂盒能够快速且有选择性地捕获 HCP,从而极大地提高了检测的灵敏度。此外,亲和配体库的广泛适用性使得该试剂盒在处理多种生物样本时都能表现出色的富集效率,同时,为了确保对样本中低浓度蛋白质进行质谱分析,试剂盒采用了质谱兼容的试剂,方便利用质谱表征的用户进行分析。这种设计和应用不仅提高了检测的准确性和可靠性,还为生物制药生产中的质量控制提供了有力工具。
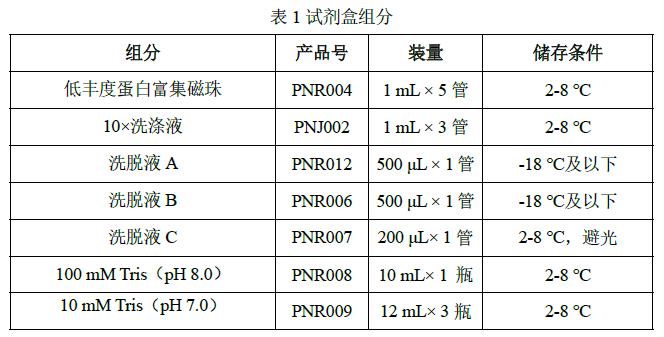
有效期为 12 个月,具体详见试剂标签。
1. ddH2O
2. 10 kDa/30 kDa 超滤管(推荐 Thermo MRCF0R030,MRCPRT010, UFC803024)
3. BCA 蛋白定量试剂盒
1. 磁板或磁力架
2. 实验室超声波清洗机
3. 垂直混匀仪
4. 漩涡振荡器
5. 恒温震荡金属浴
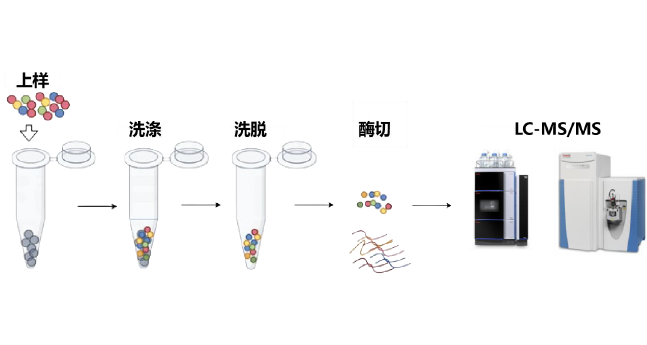
图 2 操作流程示意图
此方法的操作步骤适用于用户后续进行凝胶电泳、分离等分析操作。如果您主要使用质谱进行表征,建议参考后续章节中的常规液相/纳升液相质谱的操作步骤。
由于样品中的表面活性剂、盐(NaCl、KCl 等)会影响到 HCP 提取效果,因此建议在使用产品前先将样品通过超滤、盐析、透析等方式将以上干扰物去除、溶液置换成 10 mM Tris(pH 7.0)。以下为样品前处理范例:
例 1-超滤法
1. 取 500 μL 20 mg/mL 生物样品加入到 30 kDa 或 10 kDa 的 500 μL 超滤管,在 10000 g-11000 g 超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
2. 加入 300 μL 10 mM Tris(pH7.0),在 10000 g-11000 g 超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
3. 重复步骤 2,1-2 次。
4. 收集超滤管内生物样品到新的离心管。
5. 已移除生物样品的超滤管可加入 50 μL 10 mM Tris(pH7.0)润洗管壁,投入到步骤 4 中的离心管。
6. 重复步骤 5,1 次。
7. 得到经由超滤处理后的生物样品。
例 2-盐析法
1. 取 500 μL 20 mg/mL 的生物样品,加入 0.35 mg 硫酸铵至 2 mL 离心管中。在此过程中,可以使用水浴超声(超声频率为 40 kHz,每超声 3 秒摇晃试管 2 秒)或短暂振荡,帮助硫酸铵完全溶解。
2. 在室温下使用垂直混匀仪(30 转/分钟)沉淀蛋白 1-2 小时或是 4 oC 下过夜沉淀蛋白。
3. 使用 15000 g 离心 15 分钟,去除上清液,保留沉淀。
4. 用 500 μL ddH2O 溶解沉淀物。
5. 将沉淀液加入到 10 kDa 的 500 μL 超滤管,在 10000 g-11000 g 超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
6. 加入 300 μL 10 mM Tris(pH7.0),在 10000 g-11000g 超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
7. 重复步骤 6,1 次。
8. 收集管内液体到新的离心管。
9. 已移除液体的超滤管可加入 50 μL 10 mM Tris(pH7.0)润洗管壁,投入到步骤 8 中的离心管。
10. 重复步骤 9,1 次。
11. 得到经由盐析处理后的生物样品。
建议:每 10 mg 样品与 100 μL 的低丰度蛋白富集磁珠反应以达到较佳的富集效率。
1. 取 100 μL 低丰度蛋白富集磁珠,用磁力架进行磁分离,去除上清,直至肉眼无可见的液滴残留。
2. 加入 500 μL ddH2O,水浴超声分散并快速洗涤磁珠(超声频率为 40 kHz,每超声 3 秒拿起试管晃动 2 秒,观察磁珠分散情况直至磁珠完全分散无肉眼可见的聚沉现象)。
3. 磁分离后去除上清,直至离心管底部无肉眼可见的液滴残留。
4. 再重复上述洗涤步骤 2 次。
1. 将磁分离后去除溶液的磁珠,加入 10 mg 已通过超滤等前处理的样品(样品蛋白质浓度范围为:10 mg/mL-100 mg/mL)。
2. 在室温下,使用垂直混匀仪(30 转/分钟)温和孵育 2-4 小时。
1. 使用磁力架将孵育后的样品磁分离并去除上清。
2. 加入 100 μL 1×洗涤液(10×洗涤液用 ddH2O 稀释成 1×洗涤液)水浴超声分散磁珠,并使用垂直混匀仪(30 转/分钟)在室温下孵育 5 分钟,磁分离后去除上清。
3. 再重复上述洗涤步骤 2 次。
配制 200 μL 洗脱液:20 μL 洗脱液 A + 180 μL 100 mM Tris(pH8.0)
1. 去除洗涤液后,加入 60 μL 洗脱液,将磁珠良好水浴超声分散于洗脱液中。
2. 使用垂直混匀仪(30 转/分钟)在室温下孵育 15 分钟。
3. 磁分离后收集上清液,并再重复此洗脱步骤 1 次。
4. 合并两次收集的上清液,此即为 HCP 的富集液。
5. 使用 BCA 法测定 HCP 富集液中的蛋白质含量。若富集后的 HCP 总量不足以满足后续实验需求,可考虑增加生物样品或磁珠的使用量(建议比例为样品与磁珠质量比 10:1 至 5:1),以达到分析所需的 HCP 总量。
1. 将 HCP 的富集液保存在-18°C 及以下,或进行下游分析。
对于需要质谱分析进行精确表征的用户,请翻阅到常规液相/纳升液相质谱的操作步骤。
n 常规液相质谱操作步骤
由于样品中的表面活性剂、盐(NaCl、KCl 等)会影响到 HCP 提取效果,因此建议在使用产品前先将样品通过超滤、盐析、透析等方式将以上干扰物去除、溶液置换成 10 mM Tris(pH 7.0)。以下为样品前处理范例:
例 1-超滤法
1. 取 500 μL 20 mg/mL 生物样品加入到 30 kDa 或 10 kDa 的 500 μL 超滤管,在 10000 g-11000 g 超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
2. 加入 300 μL 10 mM Tris(pH7.0),在 10000 g-11000 g 超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
3. 重复步骤 2,1-2 次。
4. 收集超滤管内生物样品到新的离心管。
5. 已移除生物样品的超滤管可加入 50 μL 10 mM Tris(pH7.0)润洗管壁,投入到步骤 4 中的离心管。
6. 重复步骤 5,1 次。
7. 得到经由超滤处理后的生物样品。
例 2-盐析法
1. 取 500 μL 20 mg/mL 的生物样品,加入 0.35 mg 硫酸铵至 2 mL 离心管中。在此过程中,可以使用水浴超声(超声频率为 40 kHz,每超声 3 秒摇晃试管 2 秒)或短暂振荡,帮助硫酸铵完全溶解。
2. 在室温下使用垂直混匀仪(30 转/分钟)沉淀蛋白 1-2 小时或是 4 oC 下过夜沉淀蛋白。
3. 使用 15000 g 离心 15 分钟,去除上清液,保留沉淀。
4. 用 500 μL ddH2O 溶解沉淀物。
5. 将沉淀液加入到 10 kDa 的 500 μL 超滤管,在 10000 g-11000 g 超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
6. 加入 300 μL 10 mM Tris(pH7.0),在 10000 g-11000g 超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
7. 重复步骤 6,1 次。
8. 收集管内液体到新的离心管。
9. 已移除液体的超滤管可加入 50 μL 10 mM Tris(pH7.0)润洗管壁,投入到步骤 8 中的离心管。
10. 重复步骤 9,1 次。
11. 得到经由盐析处理后的生物样品。
1. 每 50 mg 生物样品,建议取 500μL-700 μL 低丰度蛋白富集磁珠(10 mg/mL)。
2. 将低丰度蛋白富集磁珠利用磁力架进行磁分离,去除上清,直至肉眼无可见的液滴残留。
3. 加入 1000 μL ddH2O,水浴超声分散并快速洗涤磁珠(超声频率为 40 kHz,每超声 3 秒拿起试管晃动 2 秒,观察磁珠分散情况直至磁珠完全分散无肉眼可见的聚沉现象)。
4. 磁分离后去除上清,直至离心管底部无肉眼可见的液滴残留。
5. 再重复上述洗涤步骤 2 次。
1. 在蛋白低吸附离心管中,将磁分离后去除溶液的 5 mg-7 mg 磁珠,加入 50 mg已通过超滤等前处理的样品(样品蛋白质浓度范围为:10 mg/mL-100 mg/mL)。
2. 在室温下,使用垂直混匀仪(30 转/分钟)温和孵育 2-4 小时。
1. 使用磁力架将孵育后的样品磁分离并去除上清。
2. 加入 500 μL-700 μL 1×洗涤液(10×洗涤液用 ddH2O 稀释成 1×洗涤液)水浴超声分散磁珠;并使用垂直混匀仪(30 转/分钟)在室温下孵育 5 分钟,磁分离后去除上清。
3. 再重复上述洗涤步骤 2 次。
配制250 μL 洗脱液:25 μL 洗脱液A + 25 μL 洗脱液B + 5 μL 洗脱液C + 195 μL 100 mM Tris(pH 8.0)
1. 去除洗涤液后,加入 100 μL 洗脱液,将磁珠水浴超声良好分散于洗脱液中。
2. 使用垂直混匀仪(30 转/分钟)在室温下孵育 10 分钟。
3. 磁分离后收集上清液,并再重复此洗脱步骤 1 次。
4. 合并两次收集的上清液,此即为 HCP 的富集液。
5. 使用 BCA 法测定 HCP 富集液中的蛋白质含量。若富集后的 HCP 总量不足以满足后续实验需求,可考虑增加生物样品或磁珠的使用量(建议比例为样品与磁珠质量比 10:1 至 5:1),以达到分析所需的 HCP 总量。
1. HCP的富集液放置于震荡金属浴中,95 ℃加热 7 分钟。
2. HCP的富集液恢复室温后,加入到 500 μL的 10 kDa超滤管中,以 10000 g超滤 15 分钟。
3. 加入 300 μL 100 mM Tris(pH 8.0),以 10000 g超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
4. 重复步骤 3,1 次。
5. 在超滤管中,加入Trypsin(胰蛋白酶:蛋白=1:50),注意若液体体积不够200 μL须补加 100 mM Tris(pH 8.0),37 oC震荡过夜酶切。
6. 收集超滤管中液体至离心管。
7. 加入LC-MS甲酸至终浓度为 1%。震荡混匀,出现白色的沉淀物。
8. 15000 g离心 15 分钟沉淀白色沉淀物,保留上清液,上清液即为HCP肽段,将液体挥干。
9. 加入 0.1%甲酸覆溶。
10. 对 50-100 μg HCP肽段进行常规液相的质谱表征。
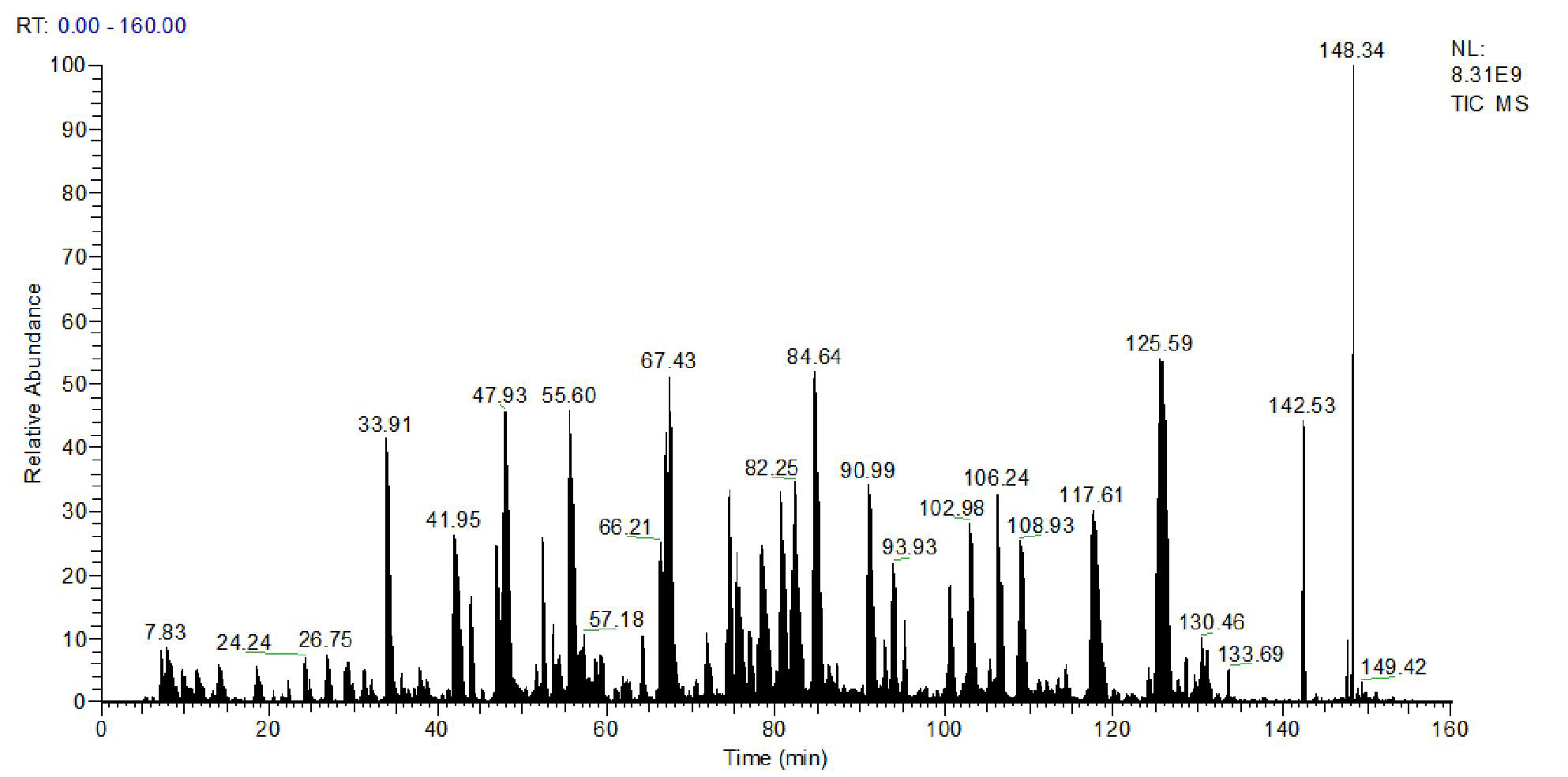
图 4 UPLC:单抗样品中的HCP质谱总离子流(TIC)图
由于样品中的表面活性剂、盐(NaCl、KCl 等)会影响到 HCP 提取效果,因此建议在使用产品前先将样品通过超滤、盐析、透析等方式将以上干扰物去除、溶液置换成 10 mM Tris(pH 7.0)。以下为样品前处理范例:
例 1-超滤法
1. 取 500 μL 20 mg/mL 生物样品加入到 30 kDa 或 10 kDa 的 500 μL 超滤管,在 10000 g-11000 g 超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
2. 加入 300 μL 10 mM Tris(pH7.0),在 10000 g-11000 g 超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
3. 重复步骤 2,1-2 次。
4. 收集超滤管内生物样品到新的离心管。
5. 已移除生物样品的超滤管可加入 50 μL 10 mM Tris(pH7.0)润洗管壁,投入到步骤 4 中的离心管。
6. 重复步骤 5,1 次。
7. 得到经由超滤处理后的生物样品。
例 2-盐析法
1. 取 500 μL 20 mg/mL 的生物样品,加入 0.35 mg 硫酸铵至 2 mL 离心管中。在此过程中,可以使用水浴超声(超声频率为 40 kHz,每超声 3 秒摇晃试管 2 秒)或短暂振荡,帮助硫酸铵完全溶解。
2. 在室温下使用垂直混匀仪(30 转/分钟)沉淀蛋白 1-2 小时或是 4 oC 下过夜沉淀蛋白。
3. 使用 15000 g 离心 15 分钟,去除上清液,保留沉淀。
4. 用 500 μL ddH2O 溶解沉淀物。
5. 将沉淀液加入到 10 kDa 的 500 μL 超滤管,在 10000 g-11000 g 超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
6. 加入 300 μL 10 mM Tris(pH7.0),在 10000 g-11000g 超滤 30 分钟以上,使溶液体积减少至原始体积 1/5。
7. 重复步骤 6,1 次。
8. 收集管内液体到新的离心管。
9. 已移除液体的超滤管可加入 50 μL 10 mM Tris(pH7.0)润洗管壁,投入到步骤 8 中的离心管。
10. 重复步骤 9,1 次。
11. 得到经由盐析处理后的生物样品。
1. 每 10 mg 生物样品,建议取 100 μL-200 μL 低丰度蛋白富集磁珠(10 mg/mL)。
2. 将低丰度蛋白富集磁珠利用磁力架进行磁分离,去除上清,直至肉眼无可见的液滴残留。
3. 加入 500 μL ddH2O,水浴超声分散并快速洗涤磁珠(超声频率为 40 kHz,每超声 3 秒拿起试管晃动 2 秒,观察磁珠分散情况直至磁珠完全分散无肉眼可见的聚沉现象)。
4. 磁分离后去除上清,直至离心管底部无肉眼可见的液滴残留。
5. 再重复上述洗涤步骤 2 次。
1. 在蛋白低吸附离心管中,将磁分离后去除溶液的 1 mg-2 mg 磁珠,加入 10 mg已通过超滤等前处理的样品(样品蛋白质浓度范围为:10 mg/mL-100 mg/mL)。
2. 在室温下,使用垂直混匀仪(30 转/分钟)温和孵育 2-4 小时。
1. 使用磁力架将孵育后的样品磁分离并去除上清。
2. 加入 100 μL 1×洗涤液 (10×洗涤液用 ddH2O 稀释成 1×洗涤液)水浴超声分散磁珠,并使用垂直混匀仪(30 转/分钟)在室温下孵育 5 分钟,磁分离后去除上清。
3. 再重复上述洗涤步骤 2 次。
配制200 μL 洗脱液:20 μL 洗脱液A + 20 μL 洗脱液B + 4 μL 洗脱液C + 156 μL 100 mM Tris(pH 8.0)
1. 去除洗涤液后,加入 60 μL 洗脱液,将磁珠水浴超声良好分散于洗脱液中。
2. 使用垂直混匀仪(30 转/分钟)在室温下孵育 15 分钟。磁分离后收集上清液。
3. 再重复上述洗脱步骤 1 次,合并两次收集的上清液,此即为 HCP 的富集液。
4. 使用 BCA 法测定 HCP 富集液中的蛋白质含量。若富集后的 HCP 总量不足以满足后续实验需求,可考虑增加生物样品或磁珠的使用量(建议比例为样品与磁珠质量比 10:1 至 5:1),以达到分析所需的 HCP 总量。
1. HCP 的富集液放置于震荡金属浴中,95 ℃加热 7 分钟。
2. 溶液恢复室温后,加入 Trypsin(胰蛋白酶:蛋白=1:50),过夜酶切。
3. 加入 LC-MS 甲酸至终浓度为 1%。震荡混匀,出现白色的沉淀物。
4. 15000 g 离心 15 分钟沉淀白色沉淀物,保留上清液,上清液即为 HCP 肽段。
5. HCP 肽段通过 Stage tip C18 进行除盐。
6. 加入 0.1%甲酸覆溶。
7. 上机,对 1 μg HCP 肽段进行纳升液相的质谱表征。
图 5 nano-LC:单抗样品中的 HCP 质谱总离子流(TIC)图
² 磁珠与生物样品孵育前,建议使用超滤等方法去除样品中的干扰物,并将溶液置换成 10 mM Tris(pH 7.0),不可为 PBS,以利 HCP 的富集。
² 通常生物样品浓度愈大,HCP 富集效果愈好。建议样品蛋白质浓度范围 10 mg/mL-100 mg/mL。
² 样品与磁珠的质量比例最优比是 10:1 至 5:1,可随着实验需求增加或降低磁珠用量。
² 在每一步加入溶液时,要将磁珠分散均匀,以达到最佳纯化效果。
² 在进行任何下游分析之前,您需要定量样品中的蛋白质含量。为此,我们建议使用 BCA 蛋白定量法进行定量。
² 在磁分离去除上清时,观察磁珠状态,勿让磁珠过于干燥,以免磁珠聚沉不易后续磁分散。
常见问题 | 可能原因 | 解决方案 |
纯化效率低 | 样品中含表面活性剂或盐。 | 超滤、透析或是盐析。 |
磁珠分散不完全,影响 HCP 富集。 | 可短暂且快速的使用超声机使磁珠 分散。 | |
洗涤过程中磁珠有损失。 | 增加磁分离时间,减少磁珠损失。 | |
磁珠附着于管壁上。 | 将离心管换成低吸附管,并借助超声 机的使用使磁珠在溶液中良好分散。 | |
分析效果 不佳 | 在分析前未将蛋白或肽段进行准 确定量导致表征效果不佳。 | 蛋白建议使用BCA 蛋白定量法定量; 肽段建议使用紫外吸收 A280 定量。 |
修订日期:2024 年 12 月 26 日
生效日期:2024 年 12 月 31 日




