

本试剂盒适用于生物制品下游纯化工艺中猪源胰蛋白酶(Trypsin)的定量测定。该试剂盒能识别市面上常见的重组猪胰蛋白酶以及胰蛋白酶(猪胰腺)。
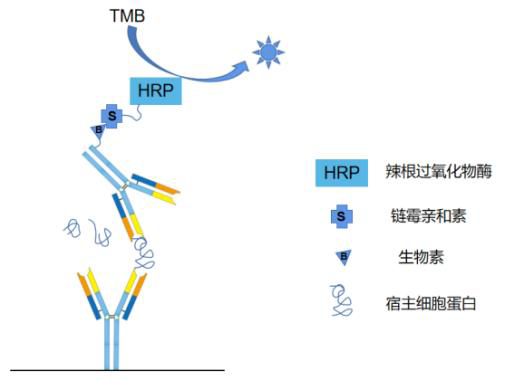
本 试 剂 盒 基 于 固 相 酶 联 免 疫 吸 附 分 析 法(ELISA),采用双抗体夹心的技术原理检测样品中Trypsin的残留量。
n 产品名称
通用名:猪源胰蛋白酶残留检测试剂盒(酶联免疫吸附法)。
n 包装规格
96 测试/盒。
本试剂盒适用于生物制品下游纯化工艺中猪源胰蛋白酶(Trypsin)的定量测定。该试剂盒能识别市面上常见的重组猪胰蛋白酶以及胰蛋白酶(猪胰腺)。该试剂盒仅供研究使用,不可用于临床。
猪源胰蛋白酶(Trypsin)是一种丝氨酸蛋白酶,可特异切割赖氨酸及精氨酸 C 末端肽键。主要用于重组胰岛素的生产,激活病毒颗粒,疫苗生产工艺中细胞的处理等。 本试剂盒基于固相酶联免疫吸附分析法( Enzyme-linked Immunosorbent Assay,ELISA),采用双抗体夹心的技术原理检测样品中 Trypsin的残留量。该分析方法通过包被针对 Trypsin 的多克隆抗体来捕获样品中的残留 Trypsin,接着加入生物素标记的抗 Trypsin 抗体进一步孵育结合,随后加入 HRP
(Horseradish Peroxidase,辣根过氧化物酶)标记的链霉亲和素,温育后洗涤;加入 TMB(3,3',5,5'-四甲基联苯胺)底物反应,HRP 催化 H2O2 氧化 TMB 生成蓝色产物(最大吸收峰 655 nm),随后加入终止液终止酶催化反应,生成黄色
产物(最大吸收峰 450 nm)。酶标仪采集 450 nm 波长下吸光度值,其吸光度与校准品和样品中的 Trypsin 浓度成正相关。通过剂量-反应曲线可计算得出样品中 Trypsin 的浓度。
该方法对样品无需特殊处理,通过实际样品的适用性验证,在合适的稀释比例进行检测。本试剂盒检测快速,专一性强,性能稳定可靠。
注:下文中 Trypsin 表示猪源胰蛋白酶。
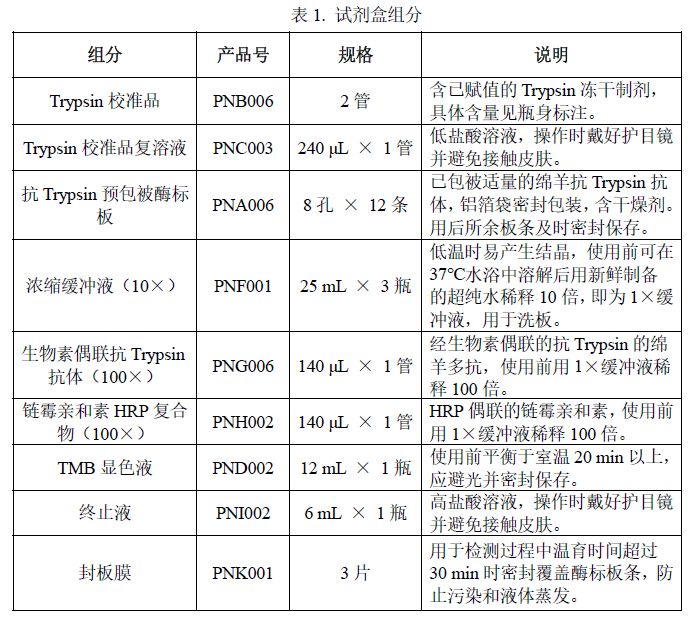
n 主要组分
1. 未开封试剂盒置 2-8 ℃保存,有效期为 12 个月。
2. 开封组分的保存要求如下:

Ø 稀释用的无菌离心管
Ø 拍干酶标板的吸水纸
Ø 加样槽
Ø 酶标仪能够检测 450 nm 吸光度值,如同时能再检测 620-650 nm 区间内任一波长的吸光度值更佳
Ø 恒温培养箱(25 ℃ ± 3 ℃)
Ø 单道和多道的微量移液器
Ø 洗板机
Ø 微孔板恒温振荡器
1. 样品:纯化工艺过程样品,原液等。应清澈透明,经离心或过滤等方式去除不溶物。
2. 存放:样品务必事先有稳定性的研究,明确最佳的保存条件;一般建议样品长期储存应放置于-65 ℃以下环境中,且不宜反复冻融。
3. 对初次使用或 Trypsin 含量未知的情况,强烈建议进行样品适用性验证,确定适宜的样品稀释倍数,以便更好进行后续常规检测。
4. 实验过程中建议加入贵司内控品或我司质控品保证实验有效性。我司质控品可单独购买。
n 操作方法
1. 实验前准备
(1) 将 Trypsin 残留检测试剂盒从 2-8 ℃冰箱取出,于室温平衡 20 min。
(2) 取出浓缩缓冲液(10×),溶液如有结晶是正常现象,于 37 ℃温育直至完全溶解。
(3) 根据检测样品数量计算所需孔数,平衡后从铝箔袋中取出相应数量的预包被酶标板条,剩余板条连同干燥剂置于铝箔袋中密封,放回试剂盒中,保存在 2-8℃冰箱,请于效期内使用完。
2. 试剂配制
2.1 Trypsin 校准品溶解
校准品原液配置,取出 Trypsin 校准品用微型离心机进行离心,精确量取 100 μL 校准品复溶液于可立冻存管中,用涡旋振荡器和微型离心机,振荡离心 3 次,复溶后校准品溶液按照推荐保存方法于效期内使用。
2.2 1×缓冲液配制
浓缩缓冲液(10×)用超纯水稀释 10 倍,例如取 25 mL 浓缩缓冲液(10×)加入 225 mL 超纯水混匀,即为 1×缓冲液,建议现配现用。
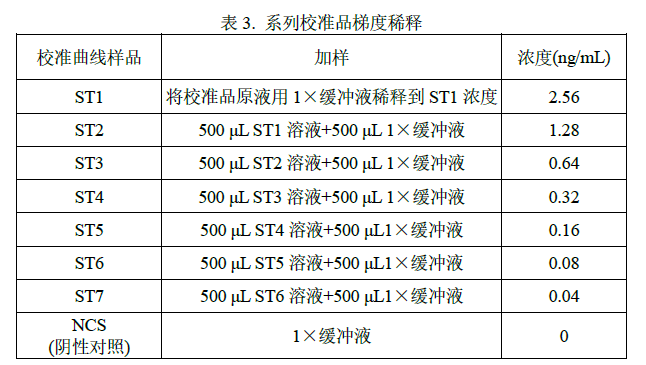
2.3 校准曲线配制
参照表 3 对校准品进行梯度稀释
2.4 样品处理
待测样品根据其预估所含的 Trypsin 浓度,用 1×缓冲液稀释适当倍数,使其检测值落入标曲定量范围之中。
3. 标准操作步骤
3.1 加样孵育
(1) 单通道移液器配合吸头准确移取 100 μL 系列校准品溶液及 1×缓冲液(NCS)加入相应微孔板中,溶液加入孔底部,操作时避免产生气泡,每个浓度做 3 个平行复孔,并记录各浓度孔所在位置。
(2) 将处理好的待测样品按同样操作加入相应微孔板中。加样后将微孔板用封板膜密封,放置于微孔板恒温振荡器上,室温,转速 500 rpm,避光孵育 1 h。
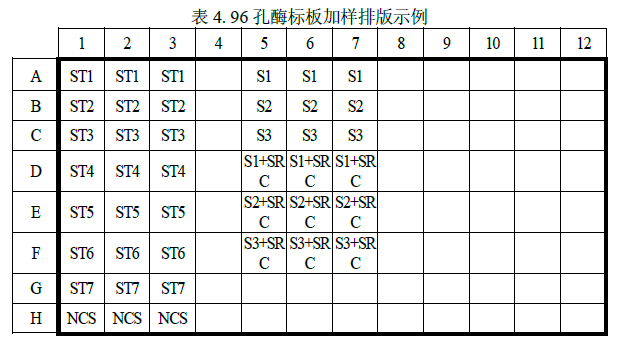
(3) 实际检测时可根据样品数量,参照下表 4 示例进行 96 孔板排版加样。
3.2 1×生物素偶联抗 Trypsin 抗体孵育
3.2.1 抗体配制
用 1×缓冲液于无菌离心管中将生物素偶联抗 Trypsin 抗体(100×)稀释 100倍,轻轻颠倒混匀 10 次,即为 1×生物素偶联抗 Trypsin 抗体。配制合适体积,以保证加液时有充足的余量。
3.2.2 洗涤
倒去微孔板内反应液,用 1×缓冲液洗板,洗板机参数设定:340 μL/孔,浸泡振荡 15 s,吸干,此步骤循环 3 次,机洗结束后,迅速甩掉液体,于纸巾上拍干。
洗板后的微孔板应立即进行后续操作,不可过久放置,避免微孔板干燥导致抗体活性下降。
3.2.3 孵育
取 1×生物素偶联抗 Trypsin 抗体溶液倒入加样槽中,用多通道移液器配合吸头快速将抗体溶液 100 μL/孔加入上述微孔板孔底部,勿引入气泡。封板膜密封后,于室温避光反应 45 min。
3.3 链霉亲和素 HRP 复合物孵育
3.3.1 复合物溶液配制
用 1×缓冲液将链霉亲和素 HRP 复合物(100×)稀释 100 倍,轻轻颠倒混匀 10次,即为 1×链霉亲和素 HRP 复合物溶液。配制合适体积,以保证加液时有充足的余量。
3.3.2 洗涤
将上述微孔板用 1×缓冲液洗板 3 次,于纸巾上拍干后,立即进行以下操作,避免干燥。
3.3.3 孵育
取 1×链霉亲和素 HRP 复合物溶液倒入加样槽中,用多通道移液器配合无菌吸头快速将溶液 100 μL/孔加入上述微孔板孔底部,勿引入气泡。封板膜密封后,于室温避光反应 30 min。
3.4 显色
(1) 将上述板子用 1×缓冲液洗板 5 次,于纸巾上拍干后,立即进行以下操作,避免干燥。
(2) 取合适体积的 TMB 显色液于加样槽中,用多通道移液器迅速将 TMB 显色液 100 μL/孔加入上述微孔板中,于室温避光反应 15 min。此步骤勿用封板膜密封。
3.5 终止
取合适体积的终止液于加样槽中,用多通道移液器迅速将终止液 50 μL/孔加入上述微孔板中,加入顺序需同显色液加入顺序一致,加样时吸头应悬空,避免接触微孔板中溶液,切勿产生气泡。终止后的微孔板于室温避光放置 5 min。
3.6 测读
设定酶标仪波长450 nm 和620-650 nm(620-650 nm 区间内单一长波长均可),测定各孔 OD 值。测定时不可覆盖封板膜或盖子。
若酶标仪没有配备长波长时,可以仅设定 450 nm 波长,但是需确保微孔板孔底干净,无指纹或刮痕
4. 结果计算
(1) 各孔 OD450 nm 数值需减去各自孔的长波长 OD 值。若酶标仪没有配备长波长时,可以省去此步骤。
(2) 各校准点的 OD 值减去 NCS(1×缓冲液对应的 OD450 nm 均值)的 OD值后,将 3 个重复孔取均值,以浓度值和 OD 值进行四参数拟合,获得校准曲线方程。将样品的平均 OD 值带入方程计算得到样品浓度。该浓度需乘以稀释倍数得到样品的实际浓度。
(3) 标曲的拟合软件可以用酶标仪自带的软件。如无,则建议采用专业的标曲制作软件,如 curve expert,ELISA Calc 等。
对于吸光度值超出校准品 ST1 的样品,可用 1×缓冲液稀释适宜倍数后再行测定,样品中 Trypsin 浓度值为稀释后测定值×稀释倍数。同时设置在该稀释度下的适宜加标样品,回收率符合相应法规的方法学验证要求。
1. 本品仅适用于研究用途,不用于临床诊断。
2. 本品仅适用于 Trypsin(猪源胰蛋白酶)残留检测。
3. 样品 pH 应保证在 6.0-8.0 之间,过低或过高的 pH 可能会造成测量值异常。
1. 校准曲线拟合范围:0.040-2.56 ng/mL,线性相关系数 R2≥0.990。
2. 最低定量限 LLOQ:0.040 ng/mL。
3. 典型校准曲线如下图:
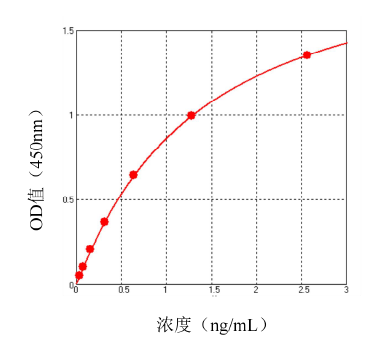
4. 精密性:板内变异系数不高于 15%,板间变异系数不高于 20%。
5. 特异性:与宿主残留蛋白(CHO、E.coli BL21、293T、Vero、汉逊酵母、 MDCK)无交叉反应。与人胰蛋白酶和牛胰蛋白酶的交叉反应率小于 0.01%。
n 重要事项提醒
试剂盒的使用人员需经过培训,合格后方可使用。为了获得满意的检测结果,请您务必事先留意如下几点事项:
1. 对初次使用或 Trypsin 含量未知的情况,强烈建议进行样品适用性验证,确定适宜的样品稀释倍数,以便更好进行后续常规检测。
2. 所有的试剂配制务必使用一次性的吸头、试管和加样槽等,充分混匀。避免微量移液器与吸头连接部分的污染,建议每次实验前后用 75%酒精擦拭移液器。规范移液操作,严禁液体倒吸至移液器中,或未去掉吸头时横放在试验台上。
3. 校准品和样品的稀释混匀要轻柔充分,勿产生大量泡沫。
4. 终止液为酸性溶液,在使用中注意眼睛、面部、手和衣服的防护。
5. 不同批次试剂盒不建议混用。
6. 配制缓冲液所用水需为无菌水或新鲜制备的超纯水,水温不得超过 37 ℃。
7. 加样时将样品加于酶标板底部,尽量不接触孔壁。注意不要有气泡,可轻轻晃动混匀。在上机检测前若有气泡存在,需用干净的 10 μL 吸头或针头等戳破,注意不要吸走孔内液体,导致结果误差大。
8. 在孵育反应时需给酶标板覆膜,防止样品蒸发。
9. 倒去缓冲液后应马上加后续溶液,勿让酶标孔处于干燥状态,以防影响试剂盒检测性能。
10. 未使用的酶标板条需用试剂盒附带的自封铝箔袋避光保存,以免被其他样品污染,导致试剂盒报废。
11. 校准品配制、样品稀释等务必精确,配制时最小的取样量不要小于 5 μL,防止结果出现较大的误差。
12. 生物素偶联抗 Trypsin 抗体(100×)和链霉亲和素 HRP 复合物(100×)试剂请在用前进行快速离心,将管盖中残留的试剂甩到管底,防止试剂的污染和损失。
13. 已稀释到工作浓度的校准品、生物素偶联抗 Trypsin 抗体、链霉亲和素
HRP 复合物等因无法保证其稳定性,不建议再次重复使用。
14. 显色液应是无色透明液体。吸取时务必更换干净的吸头,防止 HRP 污染。如发现已有淡蓝色,请弃用。
15. 终止 5 min 后再上机检测,结果更稳定。
16. 由于叠氮钠能抑制 HRP 活性,对检测结果有很大影响,因此样品中不能添加叠氮钠。
17. 推荐使用多孔道洗板机进行洗板,无洗板机可进行手工洗板。
若实验结果出现异常,请及时对未使用的酶标板和试剂进行妥善保管,对显色的酶标板实验结果拍照,保留实验原始数据。联系我司技术支持为您解决问题。以下常见的异常现象及解决方法供您参考:
问题描述 | 可能原因 | 解决方法 |
1. 使用无菌或新制备的超纯水稀释缓 | ||
冲液; | ||
1. 稀释所用的水污染; | 2. 移液器应专用,并使用无菌带滤芯吸 | |
2. 配液所用移液器、吸 | 头; | |
头、离心管等耗材污 | 3. 试验操作分区; | |
背景信号高:样品稀释液对应 OD450 值超过 0.150 | 染; 3. 操作环境不洁净; 4. Trypsin 校准品稀释过程中造成污染; 5. 洗板操作不规范; | 4. 校准品稀释操作应规范,瓶(管)口切勿触碰移液器外壁,造成管间交叉污染; 5. 手动洗板时移液器吸头应悬空,切勿 触及管内液面; |
6. 洗板次数不够,加液量 | 6. 严格按照说明书推荐的加液量、洗板 | |
不足,浸泡时间不足; | 次数和浸泡时间,切勿随意更改; | |
7. 试剂错配。 | 7. 生物素偶联抗 Trypsin 抗体(100×) | |
或者链霉亲和素 HRP 复合物(100×) | ||
使用时未稀释 100 倍或稀释错误。 | ||
1. 手动洗板过程中,甩液不迅速,或反复多次甩 | 1. 手动洗板时,甩液应一次完成,快速彻底; 2. 板子拍干用的纸巾是一次性用品,不得重复使用。在纸巾上拍干时,每拍一次更换一个新位置或新纸张,勿使拍痕重叠,若残留液体造成纸巾湿透,应弃去旧纸巾,重新铺就多层纸巾,每洗板一次拍干 4~5 次为宜; 3. 加样应匀速加于微孔板孔底部,防止加在孔壁上缘,飞溅造成邻近孔污染; 4. 微孔板孵育时应覆盖封板膜防止液体蒸发和污染杂物; 5. 揭开封板膜时,将微孔板平放在水平桌面上,用一只手的拇指和食指紧紧压在板子两侧防止移动,另一只手从一个角开始匀速揭开封板膜,过程中 要始终保持板子不离开桌面,防止孔内液体飞溅。 | |
板,造成孔间液体飞溅 | ||
交叉污染; | ||
读数后某些孔 | 2. 手动洗板后,纸巾上拍 干时操作不当或未更 | |
OD 值异常偏高 | 换新纸巾; | |
3. 加样操作不当; 4. 温育时未覆盖封板膜; 5. 揭开封板膜时操作不当, 导致孔内液体飞 | ||
溅。 |
1、YY/T 1183-2010 酶联免疫吸附法检测试剂(盒)。
2、中国药典(2020)生物制品通则《生物制品生产用原材料及辅料质量控制》。
生效日期:2023 年 01 月 09 日




