

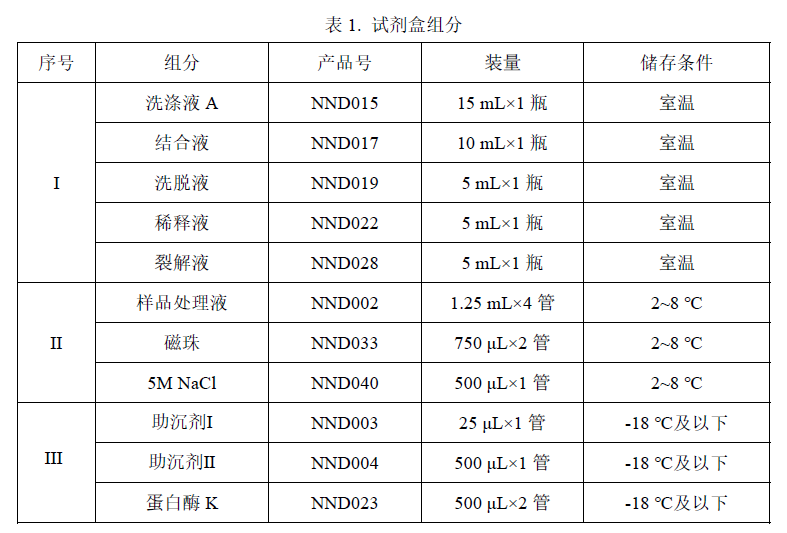
MycoSHENTEK®支原体 DNA 提取纯化试剂盒(2G)(磁珠法)用于提取纯化生物样品中的微量支原体 DNA,包括主细胞库、工作细胞库、病毒种子批等,同时对高浓度细胞(不大于 107 个)、高浓度质粒、5%人血白蛋白等复杂基质生物制品均适用,与 MycoSHENTEK® 支原体检测试剂盒(2G)(PCR-荧光探针法)配套使用,参照 EP 2.6.7和 JP XVIII 支原体检测相关要求进行验证,检测限可达 10 CFU/mL。
对于样品体积小于 400 μL 的样品,可以直接使用本试剂盒进行提取;对于超过此体积的,可通过离心将样品浓缩至终体积为约 400 μL,再使用本试剂盒进行支原体 DNA提取纯化。
本试剂盒可以手动操作,也可以通过 rHCDpurify®实现样品的自动化处理。
50 Extractions。
规定储存条件下 24 个月,具体详见试剂盒标签。
Ø 无菌超纯水
Ø 无水乙醇(分析纯)
Ø 100%异丙醇(分析纯)
Ø PCR 八联管或 96 孔板,相应管盖或覆膜
Ø 1000 μL,100 μL,10 μL 无菌低吸附滤芯枪头
Ø 1.5 mL,2.0 mL 或 50 mL 无菌低吸附离心管
Ø 支原体阳性对照品,联系本公司订购
Ø迷你离心机
Ø磁性分离架或 rHCDpurify®
Ø高速冷冻离心机
Ø漩涡振荡器
Ø恒温金属浴
Ø1000 μL,100 μL,10 μL 移液枪
Ø荧光定量 PCR 仪
Ø生物安全柜或洁净工作台
Ø八联管或 96 微孔板混匀仪
n 实验操作流程
Ø 在新开启的洗涤液 A 中加入 20 mL 的无水乙醇。
Ø 在干净的试剂瓶中用无水乙醇和灭菌超纯水配制 70%乙醇溶液,标记为洗涤液 B。
Ø 配制后的洗涤液应密封,室温保存,防止乙醇挥发(注意使用效期)。
Ø 将内部质控(IC)(2G)*冻干粉 16000×g 离心 2 分钟,加入 600 μL DNA稀释液。振荡混匀后快速离心,该操作重复三次。
* 内部质控(IC)(2G)和 DNA 稀释液为支原体检测试剂盒(2G)(PCR-荧光探针法)试剂盒成分。
Ø 准备好 100%的异丙醇。
Ø 准备好金属浴温度,55 ℃(或 25 ℃)、70 ℃。
使用前若发现裂解液、结合液出现结晶或沉淀,应 37 ℃金属浴处理,待完全溶解后,振荡混匀。
Ø 离心前需将离心机温度设置为 2-8℃。
Ø 使用前应提前将磁珠置于室温环境下平衡 10 分钟,使用前振荡均匀。
Ø 工作结合液配制:
单个样品工作结合液的准备:
200 μL 结合液+5 μL 稀释后的助沉剂Ⅰ+9 μL 助沉剂Ⅱ。助沉剂Ⅰ稀释:根据使用体积将其用 DNA 稀释液稀释 100 倍。
按照上述单个样品的工作结合液用量和样品数,计算和配制本次实验所需的工作结合液总量。
u 待测样品处理操作流程如下:
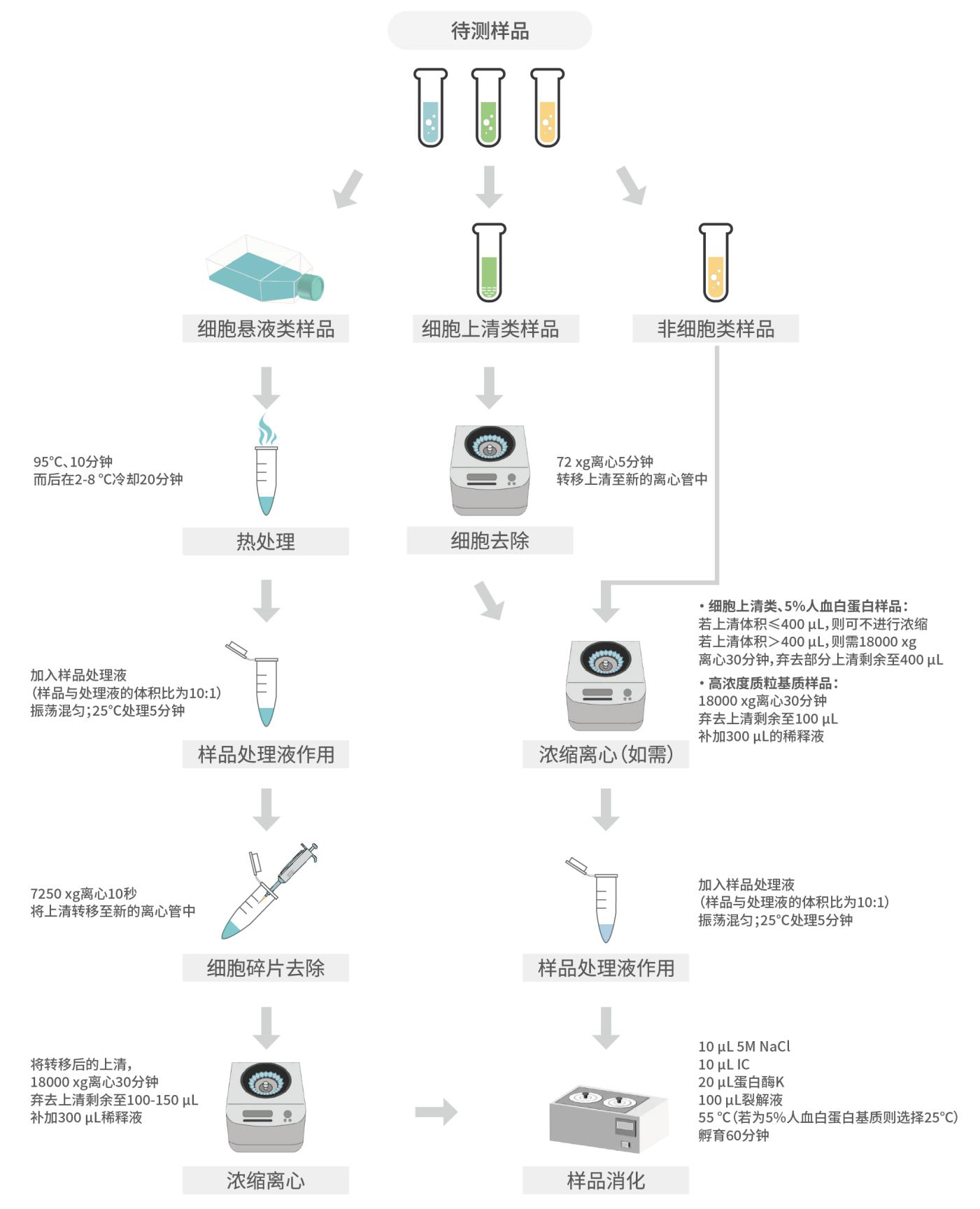
根据样品类型选择下述的样品处理步骤:
1) 热处理:首先需进行 95 ℃、10 分钟热处理,而后在 2-8 ℃冷却 20 分钟。
2) 样品处理液作用:冷却后,加入样品处理液(样品与处理液的体积比为 10∶1),涡旋振荡混匀,25 ℃处理 5 分钟。
3) 细胞碎片去除:7250×g 离心 10 秒;离心后,将上清转移至新的离心管中。
4) 浓缩离心:将转移后的上清,18000×g 离心 30 分钟;从离心机中取出,弃去上清剩余至 100-150 μL;补加 300 μL 稀释液,涡旋振荡混匀,瞬时离心 3 秒。
² 高浓度质粒基质样品
1) 浓缩离心:18000×g 离心 30 分钟,离心结束后从离心机中取出,弃去上清剩余至 100 μL;补加 300 μL 的稀释液。
2) 样品处理液作用:加入样品处理液(样品与处理液的体积比为 10:1),涡旋振荡混匀,25 ℃处理 5 分钟,而后瞬时离心 3 秒。
1) 浓缩离心:若样品体积≤400 μL,则可不进行浓缩;若样品体积>400 μL,则需 18000 ×g 离心 30 分钟,弃去部分上清剩余至 400 μL。
2) 样品处理液作用:在浓缩后的样品中加入样品处理液(样品与处理液的体积比为 10∶1),涡旋振荡混匀,25 ℃处理 5 分钟,而后瞬时离心 3 秒。
1) 细胞去除:72×g 离心 5 分钟,沉淀细胞,转移上清至新的离心管中。
2) 浓缩离心:若上清体积≤400 μL,则可不进行浓缩;若上清体积>400 μL,则需 18000×g 离心 30 分钟,弃去部分上清剩余至 400 μL。
3) 样品处理液作用:在浓缩后的样品中加入样品处理液(样品与处理液的体积比为 10∶1),涡旋振荡混匀,25 ℃处理 5 分钟,而后瞬时离心 3 秒。
Ø 阴性对照样品(NCS)
取 100~400 μL 稀释液(体积可与待测样品体积保持一致)。加入样品处理液(样品与处理液的体积比为 10:1),涡旋振荡混匀,25 ℃处理 5 分钟,而后瞬时离心 3 秒。
Ø 阳性对照样品(PCS)
取支原体阳性对照品,加入稀释液或样品基质(总体积可与待测样品体积保持一致),涡旋振荡混匀,瞬时离心 3 秒。加入样品处理液(样品与处理液的体积比为 10:1),涡旋振荡混匀,25 ℃处理 5 分钟,而后瞬时离心 3 秒。
注意若加入样品基质需按照对应基质前处理方法进行操作。
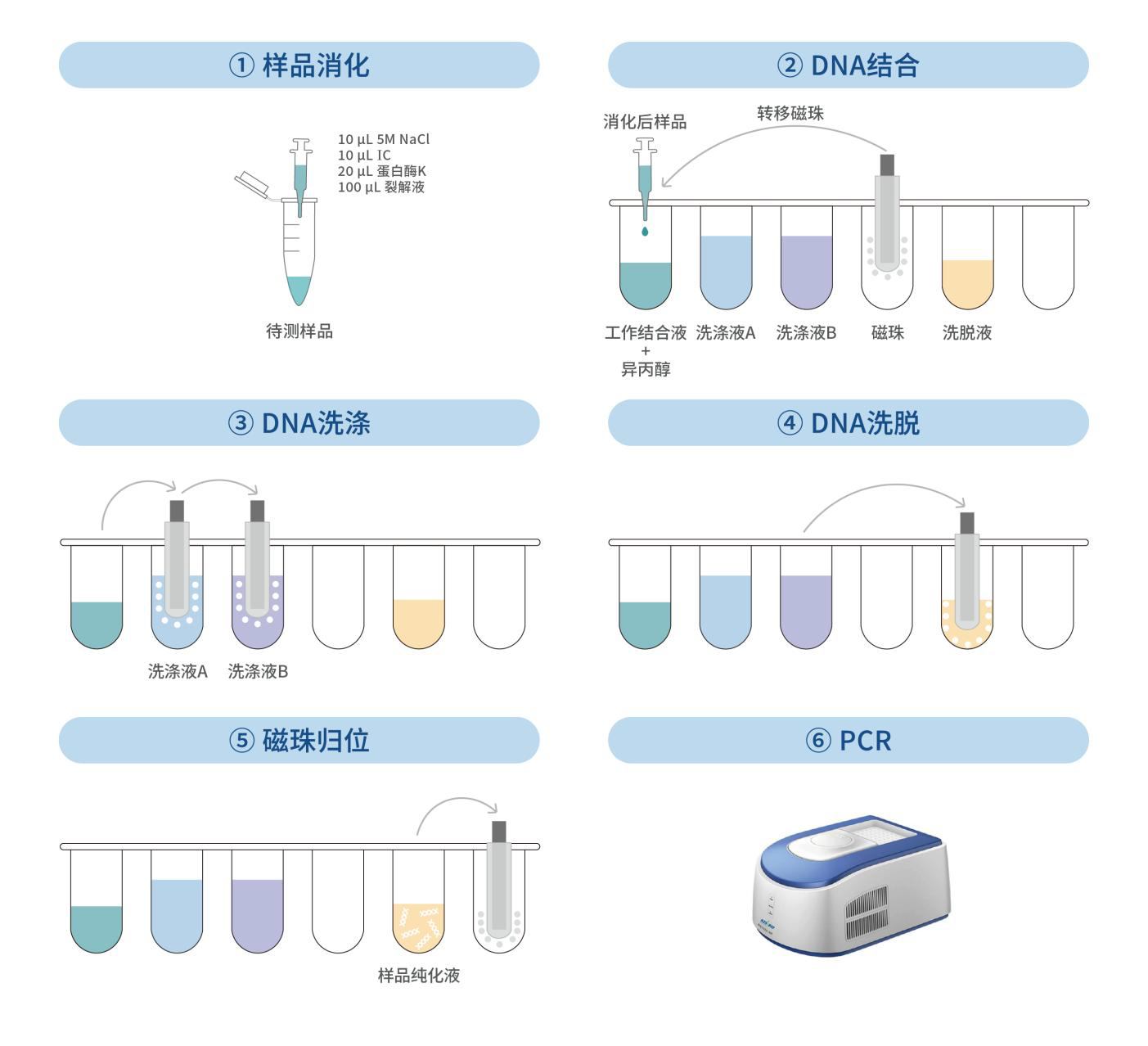
1. 在所有样品中,加入 10 μL 5M NaCl、10 μL IC,涡旋振荡混匀,瞬时离心 3 秒。
2. 在所有样品中,加入 20 μL 蛋白酶 K、100 μL 裂解液,涡旋振荡混匀,瞬时离心 3 秒,然后 55 ℃孵育 60 分钟,若基质为 5%人血白蛋白则需 25 ℃孵育 60 分钟。
为了使样品消化更加完全,可在孵育至 30 分钟左右时再次进行涡旋振荡混匀后继续孵育。
注意样品预处理好后需尽快进行下述的 DNA 提取实验!
(一)操作过程(手工操作)
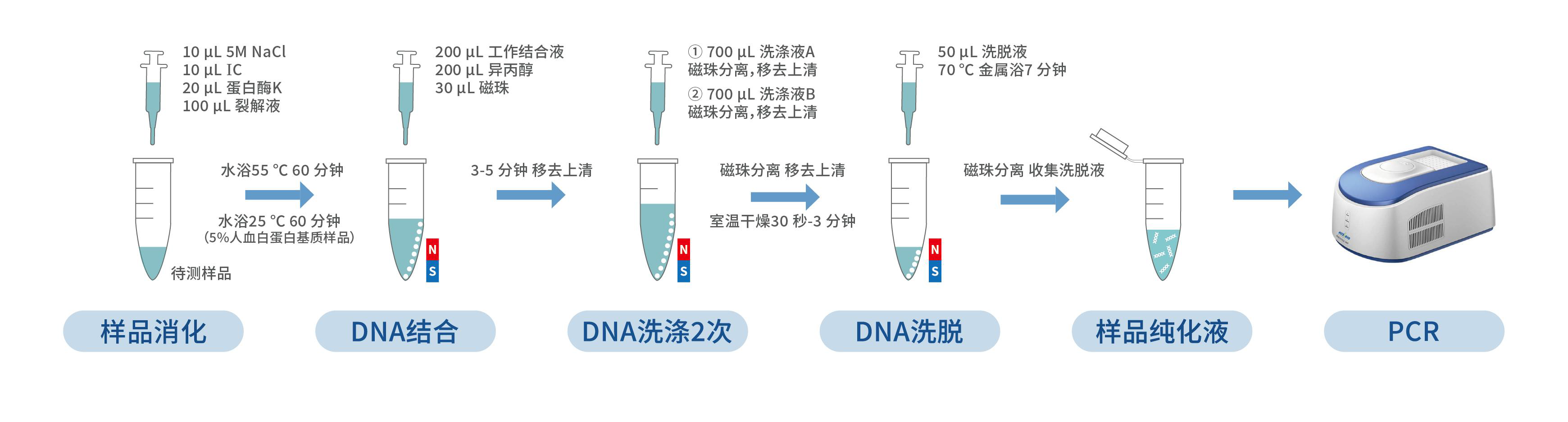
1. 将磁珠置于室温环境下 10 分钟,振荡混匀。
2. 从金属浴中取出样品,瞬时离心 3 秒,加入 200 μL 工作结合液,振荡混匀,瞬时离心 3 秒。
3. 向样品混合物中分别加入 200 μL 异丙醇,30 μL 磁珠。
如果样品较多,每次加入磁珠过程中应再次充分振荡磁珠混匀,以保证每次加入的磁珠量一致。
4. 将装有全部混合物的离心管置于漩涡振荡器上振荡 5 分钟,离心 10 秒后静置于磁性分离架上。
离心的目的在于将附着在离心管盖和壁上的混合物甩至管底。
5. 待溶液澄清,磁珠完全分离后,用枪头小心移去上清。
等待磁珠完全分离的时间约为 3 - 5 分钟。
去除上清时枪头避免搅动磁珠,避免磁珠同上清一起被去除。
1. 从磁性分离架上取下含有磁珠的离心管,加入 700 μL 洗涤液 A,振荡 10 秒使磁珠和洗涤液 A 混匀;快速离心 10 秒后,将离心管重置于磁性分离架上。待溶液澄清,磁珠完全分离后,用枪头移去上清液,完成第 1 次磁珠洗涤。
2. 从磁性分离架上取下含有磁珠的离心管,加入 700 μL 洗涤液 B,振荡 40 秒使磁珠和洗涤液 B 混匀;快速离心 10 秒后,将离心管重置于磁性分离架上。待溶液澄清,磁珠完全分离后,用枪头移去上清液,完成第 2 次磁珠洗涤。
3. 为保证液体充分移除,可将离心管再次快速离心 10 秒,置于磁性分离架上,待磁珠完全分离后,用 10 μL 枪头小心的将残余液体吸除干净。
![]() 去除上清时枪头避免搅动磁珠,避免磁珠同上清一起被去除。
去除上清时枪头避免搅动磁珠,避免磁珠同上清一起被去除。
4. 从磁性分离架上取下离心管,打开管盖在室温下干燥 30 秒- 3 分钟,除去残留的乙醇。
![]() 干燥时间依具体情况而定,室温较高或空气干燥的环境下可以选择较短干燥时间;而室温较低或空气湿润环境下,干燥时间可以稍长。
干燥时间依具体情况而定,室温较高或空气干燥的环境下可以选择较短干燥时间;而室温较低或空气湿润环境下,干燥时间可以稍长。
1. 沿离心管壁加入 50 μL 预热的洗脱液,用漩涡振荡器轻微振荡 5 秒使磁珠和洗脱液混匀,70 ℃金属浴 7 分钟,金属浴过程中可再次振荡混匀 2 - 3 次。
![]() 振荡后需将残留于管壁上的磁珠和洗脱液轻甩至管底。
振荡后需将残留于管壁上的磁珠和洗脱液轻甩至管底。
![]() 振荡至管盖上的磁珠和洗脱液需快速离心后重新振荡混匀。
振荡至管盖上的磁珠和洗脱液需快速离心后重新振荡混匀。
2. 孵育完成后,将离心管快速离心 1 分钟,然后静置于磁性分离架上,待磁珠分离后,用枪头小心转移溶液到干净的离心管中。
3. 将上一步获得的离心管快速离心 10 秒,然后静置于磁性分离架上,待磁珠分离后,用枪头再次转移溶液到干净离心管,所得即为样品纯化液。
收集洗脱液时,应将离心管内溶液转移完全,离心管内不得残留液体,否则将影响样品检测的准确性。
按照下述 96 深孔板排布预先加入相应溶液:
第一组 | 第二组 | ||||||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
S1 | PCS | ||||||||||
S2 | |||||||||||
S3 | |||||||||||
S4 | |||||||||||
S5 | |||||||||||
S6 | |||||||||||
S7 | |||||||||||
S8 | NCS | ||||||||||
工作结合液 + 异丙 醇 |
洗涤液 A |
洗涤液 B |
磁珠 |
洗脱液 |
/ | 工作结合液 + 异丙 醇 |
洗涤液 A |
洗涤液 B |
磁珠 |
洗脱液 |
/ |
样品 | 样品 | ||||||||||
其中:
第 1 或 7 列:工作结合液 200 μL/孔,异丙醇 200 μL/孔,消化后的全部样品
第 2 或 8 列:洗涤液 A 700 μL/孔
第 3 或 9 列:洗涤液 B 700 μL/孔
第 4 或 10 列:磁珠 30 μL/孔
第 5 或 11 列:洗脱液 65 μL/孔
样品可在其他试剂全部加完后再加。
1. 电源键打开—点击“登录”输入账号及密码—进入主界面。
2. 75%酒精棉球擦拭仪器内壁—点击“紫外灯”—选择“15 分钟”。
此步骤可在提取准备操作之前进行。
3. 将加好样的 96 深孔板放入仪器中固定位置,并把塑料套管插入磁头对应位置。
4. 点击“运行”—选择“Myco-2G”程序—扫描试剂盒上二维码—仪器运行约 43 分钟。
5. 程序结束,发出“滴滴”声,立即取出深孔板,将样品纯化液全部转移到新的离心管内。
1. 建议将实验室内部进行分区,分为阴性区(阴性对照样品处理、PCR 试剂的配制、阴性模板加样)、阳性区(样品操作)、扩增区等,做好明显的标识。每个区域配备独立的设备、试剂及耗材,不得交叉使用。实验试剂、待测样品、PCR 产物应分开存放,不应放于同处。减少在实验区内不必要的走动,以降低污染发生概率。
2. 实验开始前确保实验室环境温度不低于 22 ℃。
3. 实验过程中选择最合适尺寸的手套并及时更换,在不同实验区域或进行模板操作后都应更换实验服、口罩、帽子及手套,以避免不同实验区域交叉污染。
4. 装有试剂的离心管在打开之前应先瞬时离心,将管壁及管盖上的液体离至管底,降低污染手套或移液枪的风险;谨慎开关反应管,防止管内液体溅出或形成气溶胶导致污染。
5. 使用过的枪头及废液必须经过消毒液浸泡消毒后,在远离实验室的场所丢弃或统一处理。
6. PCR 扩增完成后,需戴上一次性手套将 PCR 管取出,观察管盖是否紧闭,管壁有否破裂,确保产物没有外漏,之后丢弃在指定处,严禁开盖。
7. 在磁性分离架上分离磁珠时,过程中可缓慢旋转离心管,加速磁珠聚集。
8. DNA 洗涤和洗脱操作时,每次振荡混匀后,都应该瞬时离心,以保证没有磁珠或液体附着于离心管盖或管壁上。
9. 在去除乙醇干燥时,观察磁珠状态,勿让磁珠太干,以免洗脱时不完全溶解。
10. 请尽量在完成样品纯化处理当天进行后续的 DNA 检测,以保证检测结果的准确性。
11. rHCDpurify 程序启动前,检查 96 深孔板和套管是否固定好。
12. rHCDpurify 仪器工作前及完成后需要紫外灭菌至少 15 分钟,并使用 75%酒精棉球将仪器内壁擦拭干净。且两次提取实验间隔至少为 30 分钟。
13. rHCDpurify 程序运行完毕后,需立即取出 96 深孔板并将洗脱液转移至新的离心管。 96 深孔板第 5 或第 11 列壁上可能会出现冷凝水珠,该现象不会影响提取效果,只需将底部洗脱液转移出来即可,且保证多于 40 μL,确保检测时所需。
修订日期:2023 年 05 月 06 日
生效日期:2023 年 05 月 12 日




