

MycoSHENTEK®支原体DNA检测试剂盒(2G)与MycoSHENTEK®支原体DNA提取纯化试剂盒(2G)配套使用,定性检测主细胞库、工作细胞库、病毒种子批以及细胞制品中是否有支原体、螺原体、无胆甾原体污染,参照EP 2.6.7和JP XVII 支原体检测相关要求进行验证,检测限为10CFU/mL。
MycoSHENTEK®支原体 DNA 检测试剂盒(2G)与 MycoSHENTEK®支原体 DNA提取纯化试剂盒(2G)配套使用,定性检测主细胞库、工作细胞库、病毒种子批以及细胞制品中是否有支原体、螺原体、无胆甾原体污染,参照 EP 2.6.7 和 JP XVIII 支原体检测相关要求进行验证,检测限为 10 CFU/mL。
本试剂盒利用荧光探针法 qPCR 技术,可定性检测约 200 种支原体、螺原体、无胆甾原体 DNA;经过多种支原体、非支原体和常见工程细胞 DNA 检测,特异性强;本试剂盒含 dUTP,可使用 UNG 酶系统以预防污染,有效避免假阳性结果的出现。
内部质控(IC)(2G)可在 PCR 扩增反应阶段加入,以判断待检样品对扩增反应是否存在抑制,防止假阴性结果的产生;也可在样品提取阶段加入,以评估提取效果。
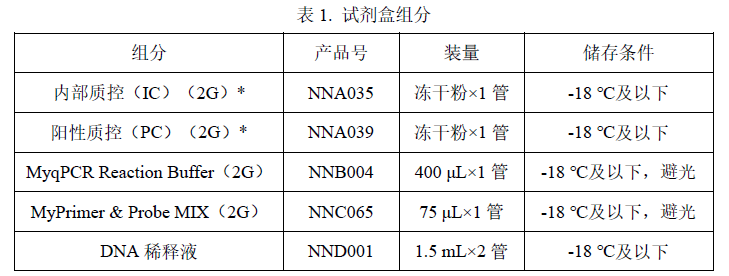
* 内部质控(IC)(2G)、阳性质控(PC)(2G)分别使用 600 μL、500 μL DNA稀释液复溶。n 规格
50 Reactions。
规定储存条件下 24 个月,具体详见试剂盒标签。
1. SHENTEK-96S
2. 7500 Real-Time PCR System
3. CFX96 定量 PCR 系统
4. Roche LightCycler 480 Ⅱ
1. 1.5 mL 或 2.0 mL 无菌低吸附离心管
2. 八联管或 96 孔 qPCR 板
3. 1000 μL,100 μL,10 μL 无菌低吸附带滤芯枪头
4. 75%酒精
5. UNG 酶(确定使用前建议验证酶效果)
1. 超净台或生物安全柜
2. 迷你离心机
3. 微孔板离心机
4. 漩涡振荡器
5. 荧光定量 PCR 仪
6. 1000 μL,100 μL,10 μL 移液枪
1. 穿戴无 DNA 污染的工作服、一次性乳胶手套、一次性无纺布帽子。
2. 工作台面、移液枪及离心管架紫外照射 30 分钟,喷洒 75%酒精并擦干。
3. 将试剂盒从冰箱-18 ℃以下区域转移至 2~8 ℃区域或冰上融化,涡旋振荡混匀并瞬时离心。
反应孔数 =(1 个阳性质控 PC + 1 个无模板对照 NTC + 1 个阴性对照样品NCS +1 个阳性对照样品(PCS)+ N 个待测样品)× 2
2.根据反应孔数计算所需的 MIX 总量:
MIX =(反应孔数+2)× 10 μL(含有 2 孔的损失量)
3.各试剂根据表 2 所示准备 qPCR MIX:
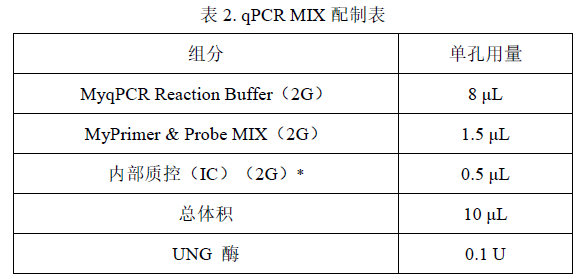
* 若样品提取时已加入 IC,则配制 MIX 时应根据表 2 使用等体积的 DNA 稀释液代替 IC。
1. 将所有溶液振荡混匀后根据表 3 所示加样,排版方式可参考表 4:
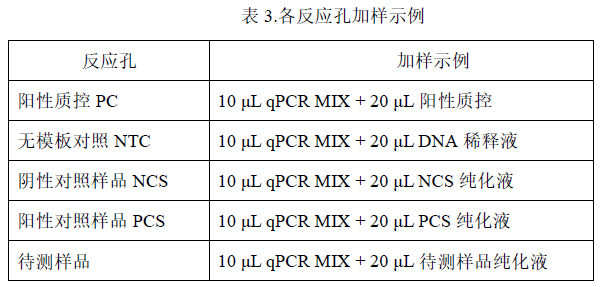
* 加样完成后体积为 30 μL /孔。
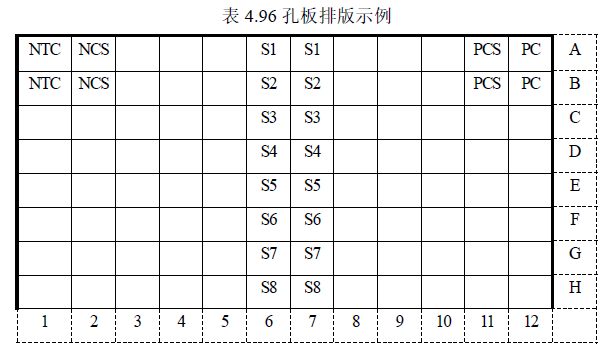
* 该示例表示的是检测 1 个阳性质控 PC、1 个无模板对照 NTC、1 个阴性对照样品 NCS、1 个阳性对照样品 PCS、8 个待测样品。每个检测做 2 个重复孔。
* 实际检测时可根据样品多少,参照此示例进行 96 孔板排版加样。
2. 将八联管用配套管盖盖紧或 96 孔版用光学膜封闭,置于 PCR 管振荡混合仪中振荡混匀,短时间快速离心 10 秒后放入 qPCR 仪。
1、以 SHENTEK-96S 实时荧光 PCR 检测系统、软件版本 8.2.2 为例。
1) 点击“实验向导”。
2) “孔板编辑”页面中选择步骤 1:选择反应孔。
3) 选择步骤 2:选择项目中的“支原体检测-2G”程序。
4) 实验运行”页面中点击“开始”运行程序。
2、其他定量 PCR 系统程序设置如下:
1) 创建空白新程序,选择绝对定量检测模板。
2) 创建新检测探针,命名为“支原体检测-2G”,选择报告荧光基团为 FAM,猝灭荧光基团为 none;创建 VIC 探针,选择报告荧光基团为 VIC,猝灭荧光基团为 none,检测参比荧光为 ROX(可选)。
3) 设置三步法反应程序:
25℃ UNG 酶 10 分钟;
95℃预变性 10 分钟;
95℃ 15 秒,62℃ 30 秒,72℃ 1 分 30 秒(读取荧光),45 个循环;反应体积 30 μL。
1、以 SHENTEK-96S 实时荧光 PCR 检测系统、软件版本 8.2.2 为例。
1) “孔板编辑”页面中步骤 3:定义反应孔,将 NTC 孔的样品类型设置为无模板对照,PC 孔设置为阳性对照,NCS 孔设置为阴性对照,待测样品孔设置为待测样品。
2) 在“实验分析”页面点击![]() , 在“反应孔信息表中”可读取无模板对照 NTC、阴性质控 NCS、待测样品的检测值。
, 在“反应孔信息表中”可读取无模板对照 NTC、阴性质控 NCS、待测样品的检测值。
2、以 7500 Real-Time PCR System、软件版本 1.4 为例。
1) 在 Results 的 Amplification Plot 面板中,将 Threshold 设置为 0.02,点击 Analyze,此时可初步查看扩增曲线的形态是否正常。
2) 在Results 的Plate 面板中,将无模板对照 NTC 孔的Task 一栏设置为NTC,将阴性质控 NCS 孔、待测样品孔、PCS 孔的 Task 一栏设置为 Unknown,并且在相应的 Sample Name 一栏中命名为 NTC、NCS、S、PCS,之后点击![]() 。 3) 在 Results 的 Report 面板中,Mean Quantity 一栏可读取无模板对照 NTC、阴性质控 NCS、待测样品、PCS 的检测值。
。 3) 在 Results 的 Report 面板中,Mean Quantity 一栏可读取无模板对照 NTC、阴性质控 NCS、待测样品、PCS 的检测值。
上述示例结果分析的参数设置仅供参考,具体需依据实验室机型及使用的软件版本进行设定,一般也可由仪器自动判读。
1. PC、NTC、NCS、PCS 检测结果参考表 5:
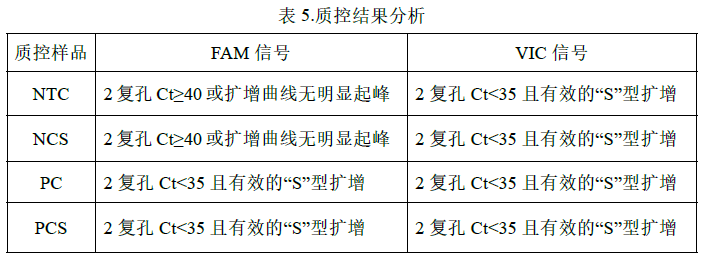
*质控标准应基于实验室验证数据,可从满足检测限要求考虑。
2. 待测样品检测结果判定参考表 6:
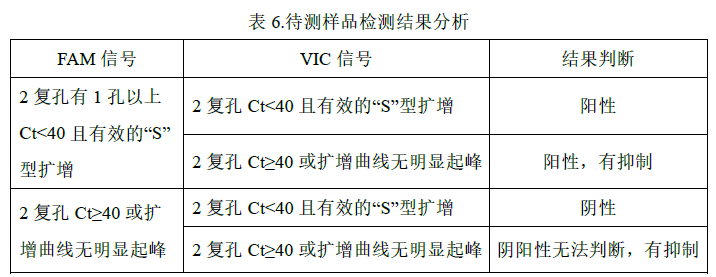
* VIC 信号如果有抑制,需重测或对样品进行合适处理消除抑制因子。
修订日期:2023 年 05 月 06 日
生效日期:2023 年 05 月 10 日




