

本试剂盒用于提取纯化细胞基质中微量分枝杆菌DNA,与 MycoSHENTEK®分枝杆菌DNA检测试剂盒配套使用。
本试剂盒可以进行手动操作,也可以通过rDNApurifyTM和rHCDpurifyTM实现样本的自动化处理。
MycoSHENTEK®分枝杆菌 DNA 提取纯化试剂盒(磁珠法)用于提取纯化生物制品中微量分枝杆菌 DNA,与 MycoSHENTEK®分枝杆菌 DNA 检测试剂盒(PCR-荧光探针法)配套使用。
对于样品体积小于 400 μL 的样品,可以直接使用本试剂盒进行提取;对于需要增加取样体积以提高检测灵敏度的,建议通过离心的方法对样品进行浓缩至终体积为 100-400 μL 后,再使用本试剂盒进行分枝杆菌 DNA 的提取和纯化。
本试剂盒可以采用手动操作,也可以通过 rHCDpurify®实现样品的自动处理。
n 试剂盒组分
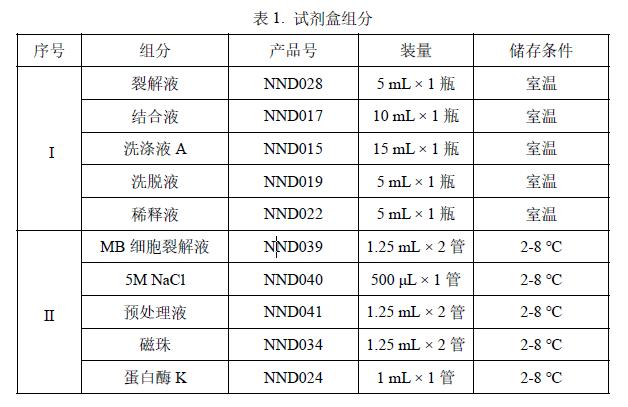
50 Extractions。
规定储存条件下 24 个月,具体详见试剂盒标签。
Ø 无水乙醇(分析纯)
Ø 100%异丙醇(分析纯)
Ø 阳性质控样品,联系本公司订购(分枝杆菌阳性对照品,货号 1503609)
Ø 1000 μL,100 μL,10 μL 无菌低吸附滤芯枪头
Ø 1.5 或 2.0 mL,50 mL 无菌低吸附离心管
Ø PCR 八联管或 96 孔板,相应管盖或覆膜
Ø 磁性分离架和 rHCDpurify®前处理系统
Ø 迷你离心机
Ø 漩涡振荡器
Ø 恒温金属浴
Ø 1000 μL,100 μL,10 μL 移液枪
Ø 生物安全柜或洁净工作台
Ø 荧光定量 PCR 仪
Ø 96 孔微孔板混匀仪
一、试剂、仪器准备
Ø 在新开启的洗涤液 A 中加入 20 mL 的无水乙醇。
Ø 在干净的试剂瓶中用无水乙醇和灭菌超纯水配制 70%乙醇溶液,标记为洗涤液B。
Ø 配制后的洗涤液应密封,室温保存,防止乙醇挥发(注意使用效期)。每次实验前需预先完成以下工作:
Ø 准备好 100%的异丙醇。
Ø 开启恒温金属浴,设置温度为 55 ℃和 70 ℃。
Ø 使用前若发现裂解液、结合液、预处理液出现结晶或沉淀,应 37 ℃水浴,待完全溶解后,振荡混匀。
Ø 使用前应提前将磁珠置于室温环境下平衡 10 分钟,使用前涡旋振荡 10 秒混匀。
u 待测样品处理操作流程如下:
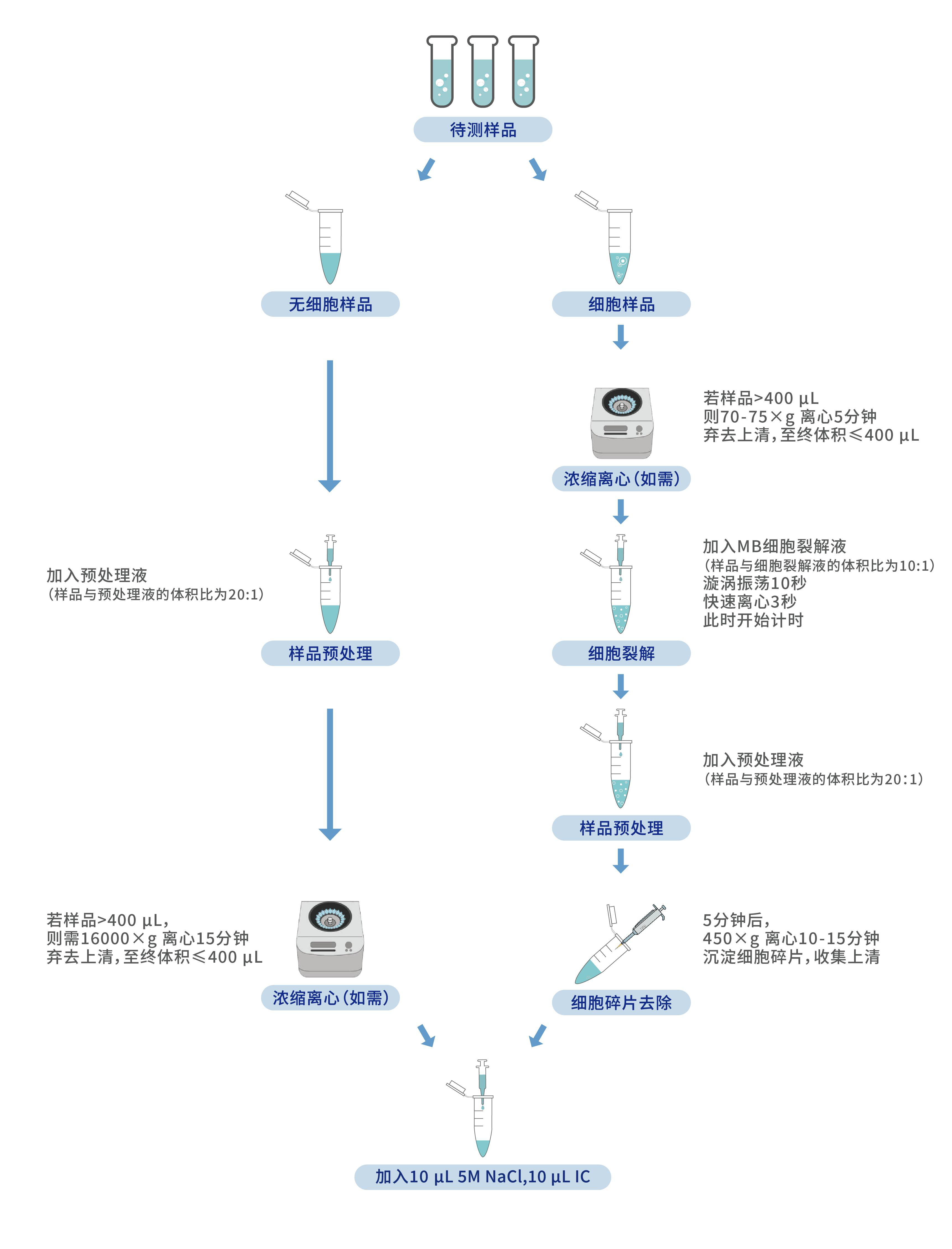
根据样品类型选择下述的样品处理步骤:
1. 加入预处理液(样品与预处理液的体积比为 20:1),涡旋振荡混匀。
2. 若样品体积≤400 μL,则可不做浓缩;若样品体积>400 μL,则需 16000×g离心 15 分钟,使用移液器移去上清,使剩余体积≤400 μL。
3. 加入 10 μL 5M NaCl,10 μL IC,涡旋振荡 10 秒,快速离心 3 秒。
1. 若样品体积≤400 μL,则可不做浓缩;若样品体积>400 μL,则 70-75×g 离心 5 分钟,使用移液器移去部分上清,使剩余体积≤400 μL。
2. 将细胞充分重悬混匀后加入 MB 细胞裂解液(样品与细胞裂解液的体积比为10:1),涡旋振荡 10 秒,快速离心 3 秒,此时开始计时。
3. 加入预处理液(样品与预处理液的体积比为 20:1),涡旋振荡混匀。
4. 5 分钟后,450×g 离心 10-15 分钟沉淀细胞碎片,使用移液器尽可能多的吸取上清转移入新的离心管,但不要吸到沉淀物。
5. 加入 10 μL 5M NaCl,10 μL IC,涡旋振荡 10 秒,快速离心 3 秒。
Ø 阴性对照样品(NCS)
1. 取 100 - 400 μL 稀释液(体积可与待测样品体积保持一致)。
2. 加入预处理液(样品与预处理液的体积比为 20:1),涡旋振荡混匀。
3. 加入 10 μL 5M NaCl,10 μLIC,涡旋振荡 10 秒,快速离心 3 秒。
1. 取 1 管分枝杆菌阳性对照品,快速离心 3 秒,加入稀释液或样品基质,涡旋振荡 10 秒,快速离心 3 秒(总体积可与待测样品体积保持一致)。
2. 加入预处理液(样品与预处理液的体积比为 20:1),涡旋振荡混匀。
3. 加入 10 μL 5M NaCl,10 μLIC,涡旋振荡 10 秒,快速离心 3 秒。
三、样品消化
1. 在上述各管样品中,加入 20 μL 蛋白酶 K,振荡混匀。
2. 再在上述各管中加入 100 μL 裂解液,振荡混匀后,55 ℃ 孵育 1 小时。为了使样品消化更加完全,需要在温育至 30 分钟左右时再次进行涡旋振荡混匀后继续孵育)。
注意样品消化后需尽快进行下述的 DNA 提取实验!四、DNA 提取
(一)操作过程(手工操作)
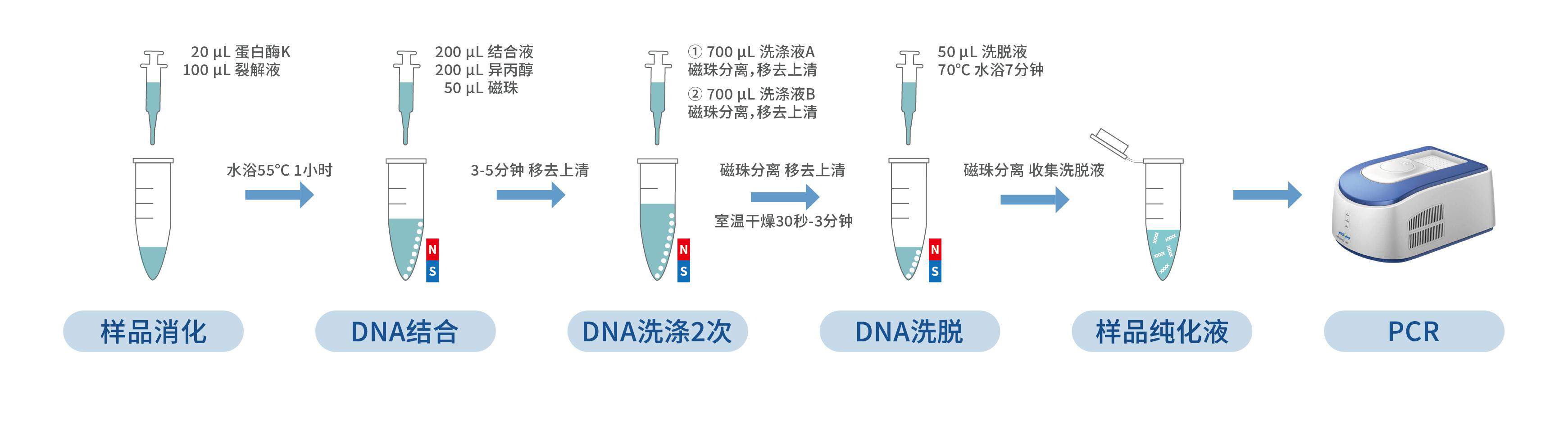
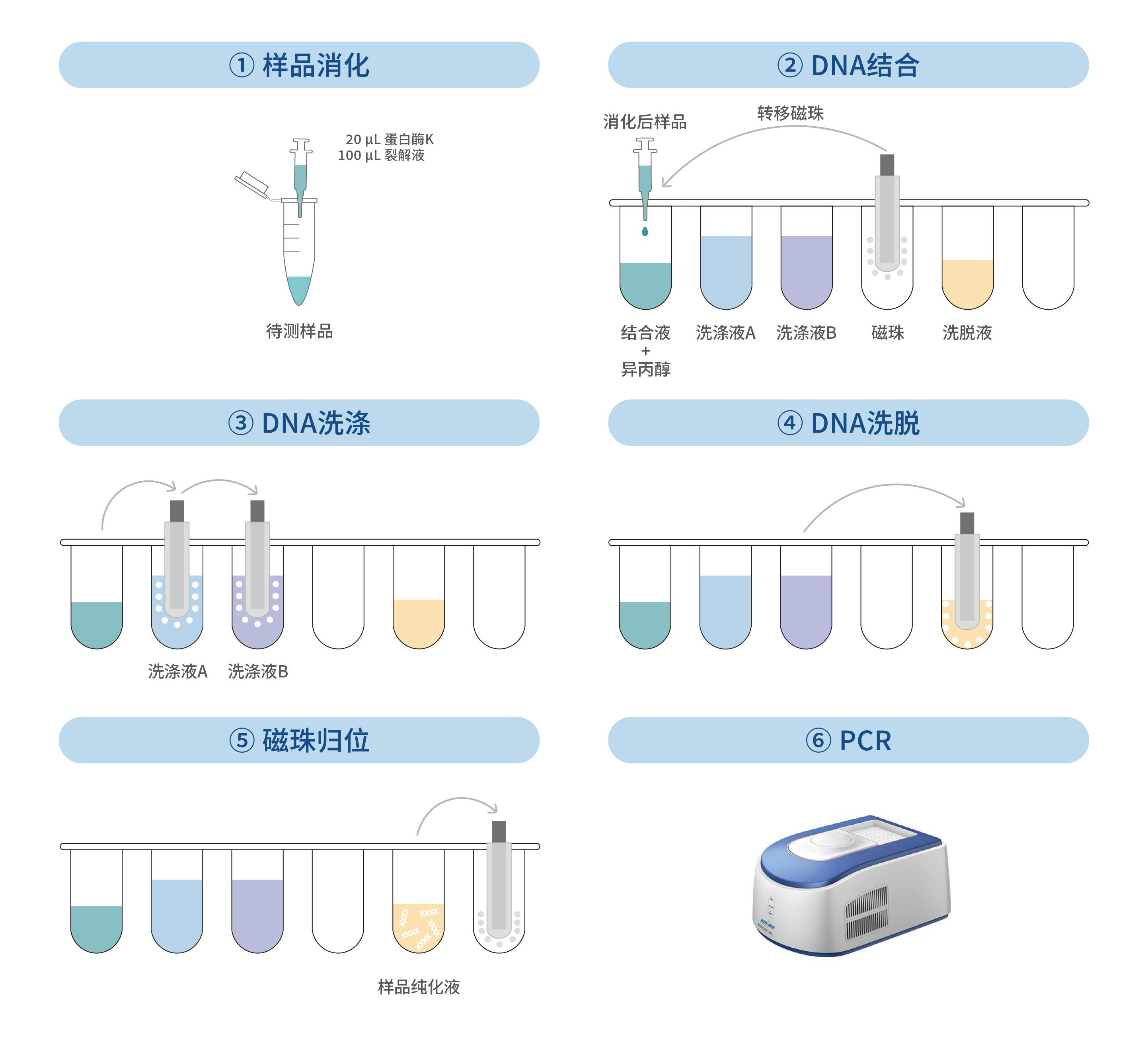
1. 将磁珠置于室温环境下 10 分钟,振荡混匀。
2. 将样品快速离心 3 秒,加入 200 μL 结合液,200 μL 异丙醇,50 μL 磁珠。
如果样品较多,每次加入磁珠过程中应再次充分振荡磁珠混匀,以保证每次加入的磁珠量的一致性。
3. 将装有全部混合物的离心管置于漩涡振荡器上振荡 5 分钟,快速离心 3 秒后静置于磁性分离架上。
快速离心的目的在于将附着在离心管盖和壁上的混合物甩至管底。
4. 待溶液澄清,磁珠完全分离后,用枪头小心移去上清。
等待磁珠完全分离的时间约为 3-5 分钟。
去除上清时枪头避免搅动磁珠,避免磁珠同上清一起被去除。
1. 从磁性分离架上取下含有磁珠的离心管,加入 700 μL 洗涤液 A,振荡 10 秒使磁珠和洗涤液 A 混匀;快速离心 3 秒后,将离心管重置于磁性分离架上。待溶液澄清,磁珠完全分离后,用枪头移去上清液,完成第 1 次磁珠洗涤。
2. 从磁性分离架上取下含有磁珠的离心管,加入 700 μL 洗涤液 B,振荡 40 秒使磁珠和洗涤液 B 混匀;快速离心 3 秒后,将离心管重置于磁性分离架上。待溶液澄清,磁珠完全分离后,用枪头移去上清液,完成第 2 次磁珠洗涤。
3. 为保证液体充分移除,可将离心管再次快速离心 3 秒,置于磁性分离架上,待磁珠完全分离后,用 10 μL 枪头小心的将残余液体吸除干净。
去除上清时枪头避免搅动磁珠,避免磁珠同上清一起被去除。
4. 从磁性分离架上取下离心管,打开管盖在室温下干燥 30 秒-3 分钟,除去残留的乙醇。
干燥时间不可过长,室温较高或空气干燥的环境下可以适当缩短干燥时间,残留乙醇会影响下一步的检测反应。
1. 沿离心管壁加入 50 μL 洗脱液,用漩涡振荡器轻微振荡 10 秒使磁珠和洗脱液混匀,70 ℃ 孵育 7 分钟,孵育过程中可再次振荡混匀 2-3 次。
振荡时不要将磁珠和洗脱液振到管盖上。
洗脱时应使洗脱液与磁珠充分混合均匀,避免磁珠附着于离心管盖和壁上导致未能充分混匀。
2. 孵育完成后,将离心管快速离心 3 秒,然后静置于磁性分离架上,待磁珠分离后,用枪头小心转移溶液到干净的离心管中。
3. 将上一步获得的离心管快速离心 3 秒,然后静置于磁性分离架上,待磁珠分离后,用枪头再次转移溶液到干净离心管,所得即为样品纯化液。
收集洗脱液时,应将离心管内溶液转移完全,保证检测时所需 40 μL 的量。
按照下述 96 深孔板排布预先加入相应溶液:
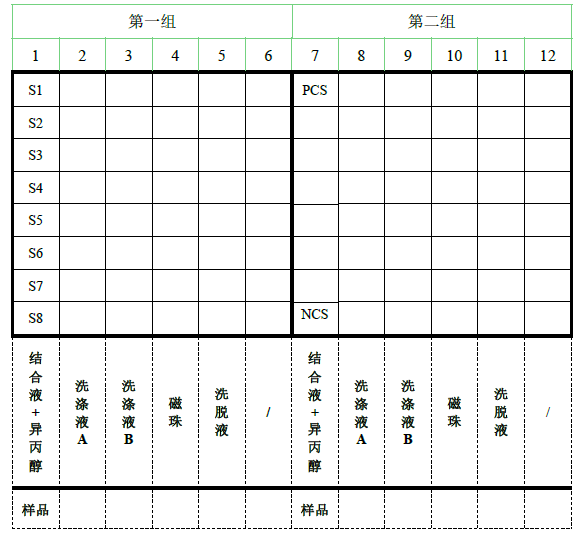
其中:
第 1 或 7 列:结合液 200 μL/孔,异丙醇 200 μL/孔,消化后的全部样品
第 2 或 8 列:洗涤液 A 700 μL/孔
第 3 或 9 列:洗涤液 B 700 μL/孔
第 4 或 10 列:磁珠 50 μL/孔
第 5 或 11 列:洗脱液 65 μL/孔
样品可在其他试剂全部加完后再加。
1. 电源键打开—点击“登录”输入账号及密码—进入主界面。
2. 75%酒精棉球擦拭仪器内壁—点击“紫外灯”—选择“15 分钟”。 此步骤可在提取准备操作之前进行。
3. 将加好样的 96 深孔板放入仪器中固定位置,并把塑料套管插入磁头对应位置。
4. 点击“运行”—选择“Myco-601”程序—扫描试剂盒上二维码—仪器运行。
5. 程序结束,发出“嘀嘀”声,立即取出深孔板,将样品纯化液全部转移到新的离心管内。
1. 建议将实验室内部进行分区,分为阴性区(阴性对照样品处理、PCR 试剂的配制、阴性模板加样)、阳性区(样品操作)、扩增区等,做好明显的标识。每个区域配备独立的设备、试剂及耗材,不得交叉使用。实验试剂、待测样品、PCR 产物应分开存放,不应放于同处。减少在实验区内不必要的走动,以降低污染发生概率。
2. 实验开始前确保实验室环境温度不低于 22 ℃。
3. 实验过程中选择最合适尺寸的手套并及时更换,在不同实验区域或进行模板操作后都应更换实验服、口罩、帽子及手套,以避免不同实验区域交叉污染。
4. 装有试剂的离心管在打开之前应先瞬时离心,将管壁及管盖上的液体离至管底,降低污染手套或移液枪的风险;谨慎开关反应管,防止管内液体溅出或形成气溶胶导致污染。
5. 使用过的枪头及废液必须经过消毒液浸泡消毒后,在远离实验室的场所丢弃或统一处理。
6. PCR 扩增完成后,需戴上一次性手套将 PCR 管取出,观察管盖是否紧闭,管壁有否破裂,确保产物没有外漏,之后丢弃在指定处,严禁开盖。
7. 在磁性分离架上分离磁珠时,过程中可缓慢旋转离心管,加速磁珠聚集。
8. DNA 洗涤和洗脱操作时,每次振荡混匀后,都应该瞬时离心,以保证没有磁珠或液体附着于离心管盖或管壁上。
9. 在去除乙醇干燥时,观察磁珠状态,勿让磁珠太干,以免洗脱时不完全溶解。
10. 请尽量在完成样品纯化处理当天进行后续的 DNA 检测,以保证检测结果的准确性。
11. rHCDpurify 程序启动前,检查 96 深孔板和套管是否固定好。
12. rHCDpurify 仪器工作前及完成后需要紫外灭菌至少 15 分钟,并使用 75%酒精棉球将仪器内壁擦拭干净。且两次提取实验间隔至少为 30 分钟。
13. rHCDpurify 程序运行完毕后,需立即取出 96 深孔板并将洗脱液转移至新的离心管。 96 深孔板第 5 或第 11 列壁上可能会出现冷凝水珠,该现象不会影响提取效果,只需将底部洗脱液转移出来即可,且保证多于 40 μL,确保检测时所需。
修订日期:2023 年 05 月 16 日
生效日期:2023 年 06 月 01 日




