

细菌内毒素能特异性地激活反应主剂中的C因子,活化的C因子激活B因子,活化的B因子进而激活凝固酶原,凝固酶水解反应中的显色底物,产生游离的pNA(对硝基苯胺)从而引起吸光度变化,根据动态检测溶液吸光度变化率对细菌内毒素浓度进行定量。
本产品用于定量测定人用和动物用注射药物、生物制品及医疗器械等样本中的细菌内毒素的含量。
细菌内毒素能特异性地激活反应主剂中的 C 因子,活化的 C 因子激活 B 因子,活化的 B 因子进而激活凝固酶原,凝固酶水解反应中的显色底物,产生游离的 pNA(对硝基苯胺)从而引起吸光度变化,根据动态检测溶液吸光度变化率对细菌内毒素浓度进行定量。
本产品用于定量测定人用和动物用注射药物、生物制品及医疗器械等样品中的细菌内毒素的含量。
该试剂盒仅供研究使用,不可用于诊断。
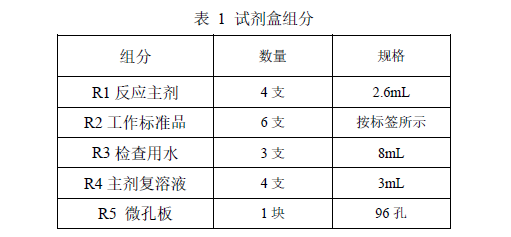
96T/盒
0.005-5 EU/mL
2-8℃储存,规定储存条件下 24 个月,具体详见试剂盒标签。
微孔板检测仪或带温浴、震板功能同时可进行动力学读数的酶标仪,所需波长 405nm。
1. 内毒素限值的确定
药品、生物制品的细菌内毒素限值(L)一般按以下公式确定:
L=K/M
L 为供试品的细菌内毒素限值,一般以 EU / mL、EU / mg 或 EU / U (活性单位)表示;
K 为人每千克体重每小时最大可接受的内毒素剂量,以 EU / (kg·h)表示,注射剂 K=5EU / (kg·h),放射性药品注射剂 K=2.5 EU / (kg·h),鞘内用注射剂 K=0.2 EU / (kg·h);
M 为人用每千克体重每小时的最大供试品剂量,以 mL / (kg·h)、mg / (kg·h)或 U /(kg·h)表示,人体重按 60 kg 计算,人体表面积按 1.62 m2 计算。注射时间若不足 1 小时,
按1 小时计算。供试品每平方米体表面积剂量乘以0.027 即可转换为每千克体重剂量(M)。
2. 供试品溶液的制备
当供试品需要控制的内毒素限值(L)大于鲎试剂的灵敏度值时,需要用检查用水对供试品进行稀释,计算公式如下:MVD=cL/λ
MVD:供试品的最大有效稀释倍数;
L:供试品需控制的内毒素限值(EU/mL)
c:为供试品溶液的浓度。当 L 以 EU/mL 表示时,则 c 等于 1.0 mL/mL;L 以 EU/mg或 EU/U 表示时,c 的单位需为 mg/mL 或 U/mL。如供试品为注射用无菌粉末或原料药,则 MVD 取 1,可计算供试品的最小有效浓度:
c=λ/L
λ:为试剂盒的标示灵敏度(EU/mL),本产品灵敏度为 0.005 EU/mL。举例:
某供试品需要控制的内毒素限值为 1 EU/mL,使用灵敏度λ=0.005 EU/mL 的鲎试剂作为细菌内毒素检查,则 MVD=200 倍,即供试品最大可稀释 200 倍后进行检查。
3. 细菌内毒素标准品溶液制备
1) 溶解:取 R2 工作标准品 1 支,按标签所示使用 R3 检查用水复溶,置涡旋混匀器上混匀至少 10 min,得 5 EU/mL 细菌内毒素标准品溶液。
2) 稀释:内毒素梯度浓度 5、0.5、0.05、0.005 EU/mL,每稀释一步均应在涡旋混匀器上剧烈震荡 2 分钟。内毒素标准溶液配制可参考下表:
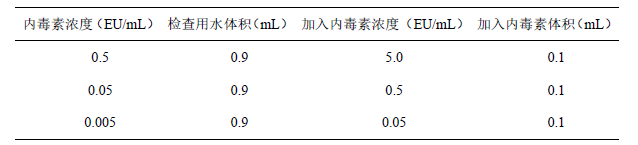
若稀释的内毒素溶液静置时间超过 10 分钟,用前须在涡旋混匀器上剧烈震荡 2 分钟,放置 4 小时以上的内毒素溶液应丢弃。
4. 阴性对照:为检查用水。
5. 主剂复溶:取主剂复溶液 2.6 mL 溶解反应主剂,振荡混匀,静置待用。
6. 实验操作
1) 在微孔板中分别加入 100 μL 标准品、阴性对照以及供试品溶液,至少 2 个复孔。
2) 向加有标准品、阴性对照以及供试品溶液的微孔中加入 100 μL 反应主剂溶液。
3) 检测前,微孔板震动 5-10 s。设定 Onset OD=0.02-0.1(起始点与终点 OD 的差值),在 37℃下,波长 405 nm 下进行检测 90 min,反应结束后得启动时间(T)。
7. 结果计算
1) 建立标准曲线
lgT=b lgC + a
其中:T 为启动时间,C 为内毒素的浓度,b 为直线斜率,a 为 Y 轴截距。
2) 根据标准曲线计算样品内毒素浓度。
注意:为保证检测结果准确性,检测时请在 5 min 内将反应主剂加入到待检测微孔板中。
当对新药或无内毒素检查项的品种建立内毒素检查法时,必须进行干扰试验;当鲎试剂、供试品的来源、配方、生产工艺改变,或试验环境中发生了任何有可能影响试验结果的变化时,必须重新进行干扰试验;当供试品中可能存在鲎试验的干扰物质时,须进行干扰试验。
步骤如下:
1. 选择标准曲线中点或一个靠近中点的内毒素浓度(设为λm),作为供试品干扰试验中添加的内毒素浓度。
2. 用供试品溶液配制浓度为λm 的内毒素溶液(即含λm 内毒素的供试品阳性对照),测量出该溶液的内毒素浓度,称为 Cs;
3. 测量出未添加外源内毒素的供试品溶液内毒素浓度,称为 Ct;
4. 计算该试验条件下的回收率 R=(Cs–Ct)/λm×100%;
5. 当 R 在 50%-200%之间,则认为在此试验条件下供试品溶液不存在干扰作用。
6. 当 R 在 50%-200%之外,需对供试品进行系列稀释或进行其它处理消除干扰,每一稀释溶液都重复步骤 2-4,直到内毒素的回收率 R 在 50%-200%之间。选择回收率 R 最接近 100%的稀释倍数进行内毒素检测。
(参见《中华人民共和国药典》细菌内毒素检查法)
1. 本品仅用于体外细菌内毒素的定量检测,禁止试剂以任何途径进入人体。
2. 试剂盒使用前仔细检查试剂盒是否破损和阅读产品说明书,发现错误和缺损禁止使用,以免影响测定结果。
3. 试剂盒中的成份可能会导致皮肤和眼睛疼痛,也可刺激黏膜和上呼吸道,应避免与皮肤接触,避免吸入和食入。
4. 实验操作应在无菌无热原的环境下,避免微生物病原体污染。
5. 供试品的 pH 值应在 6.0-8.0 之间,若超出此范围,需用除热原的缓冲液(内毒素浓度小于 0.005 EU/mL)、0.1 M 氢氧化钠或 0.1 M 盐酸调节。
6. 当供试品中可能存在鲎试验的干扰物质时,须进行干扰试验,参见【供试品的干扰试验】。
[1] Levin J.The role of endotoxin in the extracellular coagulation of limulus blood[J]. Bull Johns Hopkins Hosp, 1964, 115.
[2] Levin J,Bang FB.Clottable protein in Limulus; its localization and kinetics of its coagulation by endotoxin[J].Thromb Diath Haemorrh. 1968 Mar 31;19(1):186-197.
生效日期:2024 年 04 月 17 日




