

本试剂盒与SHENTEK®病毒核酸提取试剂盒(磁珠法)配套使用,适用于快速检测牛血清和细胞中5 种牛源性病毒污染:牛病毒性腹泻病毒(Bovine ViralDiarrhea Virus,BVDV),呼肠孤病毒3 型(Reovirus 3,REO-3),牛副流感病毒3 型(Bovine Parainfluenza 3 Virus,PI-3),牛细小病毒3 型(Bovine Parvovirus 3,BPV-3)和牛腺病毒3 型(Bovine Adenovirus type 3,BAV-3)。
n 试剂盒简介
SHENTEK®牛源病毒(BVDV/REO-3/PI-3/BPV-3/BAV-3)多重核酸检测试剂盒(多重 PCR-荧光探针法),与 SHENTEK®病毒核酸提取试剂盒(磁珠法)配套使用,适用于快速检测牛血清和细胞中 5 种牛源性病毒污染:牛病毒性腹泻病毒(Bovine Viral Diarrhea Virus,BVDV),呼肠孤病毒 3 型(Reovirus 3,REO-3),牛副流感病毒 3 型(Bovine Parainfluenza 3 Virus,PI-3),牛细小病毒 3 型(Bovine Parvovirus 3,BPV-3)和牛腺病毒 3 型(Bovine Adenovirus type 3,BAV-3)。
本试剂盒利用荧光探针多重 qPCR 技术,可实现在单孔中同步检测 3 种 RNA 病毒(BVDV/REO-3/PI-3)或 2 种 DNA 病毒(BPV-3/BAV-3),用于在生物制品中对动物源性原辅料、细胞库、病毒种子库、未加工收获液和最终产品等进行快速高效的牛源性病毒污染检测。试剂盒检测灵敏度高特异性强,检测限低至 50 copies/反应。试剂盒包含内部质控 IC,结果可靠。配合 SHENTEK®病毒核酸提取试剂盒(磁珠法)可在细胞、血清等复杂基质样品中高效回收病毒核酸。
n 试剂盒组分
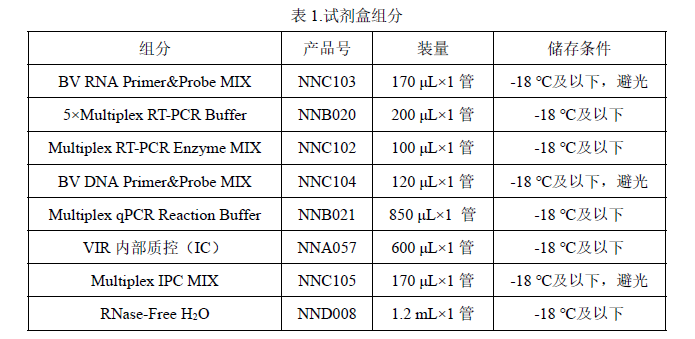
50 Reactions。
规定储存条件下 24个月,具体详见试剂盒标签。
1. SHENTEK-96S 定量 PCR 系统
2. 7500 Real-Time PCR System
3. Roche LightCycler 480 Ⅱ
1. 1.5 mL 或 2.0 mL 无菌 DNase/RNase-free 低吸附离心管
2. 96 孔 qPCR 板或八联管
3. 1000 μL,200 μL,100 μL,10 μL DNase/RNase-free 低吸附带滤芯枪头
4. RNase 抑制剂
5. 病毒核酸提取试剂盒(货号:1506730)
6. BVDV,REO-3,PI-3,BPV-3,BAV-3 阳性对照品(货号:1506736,1506737,
1506738,1506746,1506739),请联系本公司订购
1. 生物安全柜
2. 迷你离心机
3. 漩涡振荡器
4. 荧光定量 PCR 仪
5. 1000 μL,200 μL,100 μL,10 μL 移液枪
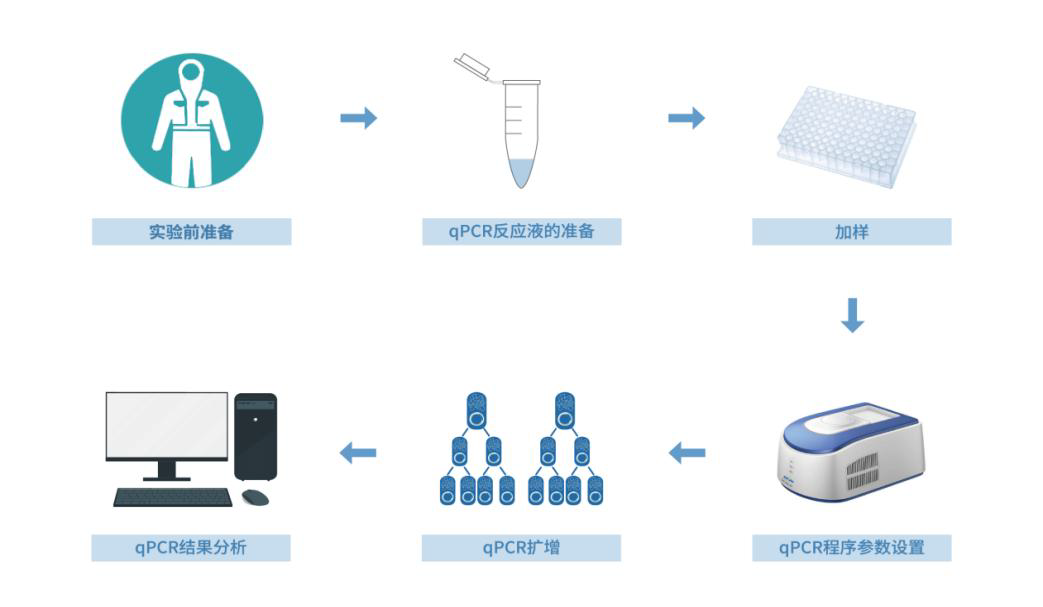
图 1 操作流程示意图
一、实验前准备
1. 穿戴适当的工作及保护服,至少穿戴无 DNA 污染的工作服、一次性反穿衣、一次性乳胶手套、一次性无纺布帽子和医用口罩。
2. 病毒提取检测和病毒阳性对照品处理建议在 P2 实验室和生物安全柜中进行。
3. 检测过程中严格使用无核酸酶的试剂和耗材。
4. 需要使用的试剂提前取出置于冰上融解并充分混匀
二、样品提取
使用病毒核酸提取试剂盒(货号:1506730)对样品中的病毒核酸提取纯化。
u 待测样品处理
细胞基质或牛血清样品处理:
取牛血清或 107 及以下细胞样品体积 100~200 μL,加入样品处理液(1/10 样品体积用量),涡旋震荡混匀,快速离心 3-5 秒,室温静置孵育 5 分钟。450×g离心 30 分钟(4 ℃),吸取上清转移到新离心管中。进行下一步样品消化。提取过程建议使用 RNase 抑制剂,终浓度为 1 U/μL。
其他类型样品可直接进行消化处理。特殊类型基质样品请咨询湖州申科技术支持!
u 对照样品准备
阳性对照品(PCS)
取 BVDV,REO-3,PI-3 阳性对照品三管混合在一起作为 BVDV/REO-3/PI-3多重检测的 PCS。取 BPV-3 , BAV-3 阳性对照品两管混合在一起作为 BPV-3/BAV-3 多重检测的 PCS。在提取阶段和同批待测样品一起进行样品处理。
阴性对照品(NCS)
取 RNase-Free H2O 或 1×PBS(同待测样品体积)作为阴性对照 NCS,在提取阶段和同批待测样品一起进行样品处理。
u 样品消化
NCS,PCS 和所有待测样品加入 100 μL 的蛋白酶K 缓冲液和 50 μL 蛋白酶K,再加入 10 μL VIR 内部质控(IC),涡旋震荡混匀,快速离心 3-5 秒,55 ℃孵育 30 分钟。孵育完成后加入 10 μL 的 5M NaCl 和 10 μL 的助沉剂 Ⅰ 工作液(即配即用)涡旋震荡混匀,快速离心 3-5 秒。
u 病毒核酸提取
建议使用 rHCD purify®前处理系统,按照病毒核酸提取试剂盒说明书流程进行病毒核酸提取。
1. 根据所要检测样品数量,计算所需反应孔数,一般做 2 个重复孔/样。反应孔数 =(1 个无模板对照 NTC + 1 个阴性对照样品 NCS+1 个阳性对照样品 PCS + N 个待测样品)×2
2. MIX 总量计算:根据反应孔数计算所需的 RT-qPCR MIX 总量。RT-qPCR MIX =(反应孔数 + 2)× 10 μL(含有 2 孔的损失量)
3. 根据表 2 准备各试剂 RT-qPCR MIX 用量。
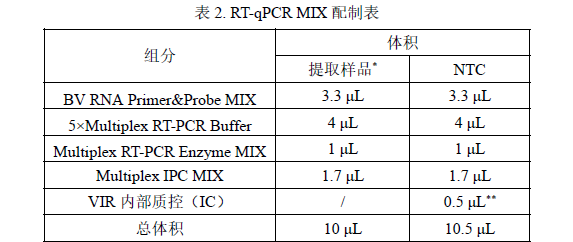
*提取样品包括待测样品,NCS 和 PCS,IC 作为内部质控在提取检测阶段加入到样品中。
**NTC 作为检测时的阴性对照需要配置单独加入 VIR 内部质控(IC)的 MIX进行检测。
1. 将所有提取纯化液 95 ℃孵育 3 分钟。
2. 将所有待检测溶液振荡混匀后按表 3 和表 4 所示加样:
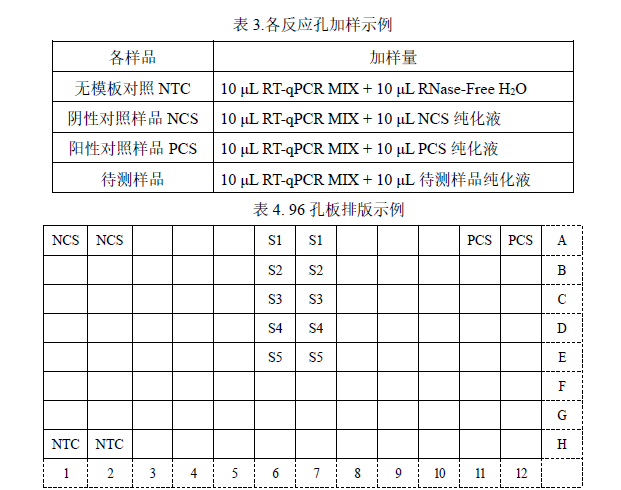
² 该示例表示的是检测 1 个阴性对照样品 NCS、1 个无模板对照 NTC、1个阳性对照样品 PCS、5 个待测样品。每个检测做 2 个重复孔。
² 实际检测时可根据样品多少,参照表 4 示例进行 96 孔板排版加样。
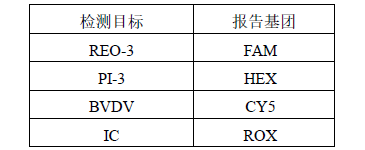
将八联管用配套管盖盖紧或 96 孔板用光学膜封闭,轻微震荡混匀,短时间快速离心 10 秒后放入 qPCR 仪,接着进行 RT-qPCR 程序设置: TaqMan 探针报告基团:
l SHENTEK-96S 实时荧光 PCR 检测系统、软件版本 8.2.2 为例:
1. 点击“实验向导”。
2. “孔板编辑”页面中选择步骤 1:选择反应孔。
3. 选择步骤 2:选择项目中的“BVDV/REO-3/PI-3 检测”程序。
4. “实验运行”页面中点击“开始”运行程序。
l 7500 Real-Time PCR System 实时荧光 PCR 检测系统、软件版本 2.4为例:
1. 创建空白新程序,选择绝对定量检测模板。
2. 创建新检测探针,命名为“REO-3”,选择报告荧光基团为 FAM,猝灭荧光基团为 None;创建新检测探针,命名为“PI-3”,选择报告荧光基团为 HEX,猝灭荧光基团为 None;创建新检测探针,命名为 “BVDV”,选择报告荧光基团为 CY5,猝灭荧光基团为 None;创建新检测探针,命名为“IC”,选择报告荧光基团为 ROX,猝灭荧光基团为 None。
3. 检测参比荧光设置为“None”。
4. 设置 RT- qPCR 反应程序: 50 ℃ 逆转录 15 分钟; 95 ℃ 预变性 30 秒;95 ℃ 15 秒,60 ℃ 1 分钟(读取荧光),40 个循环;反应体积 20 μL。
l 以 SHENTEK-96S 实时荧光 PCR 检测系统、软件版本 8.2.2 为例:
1. “孔板编辑”页面中步骤 3:定义反应孔,将 NTC 孔的样品类型设置为无模板对照,NCS 孔设置为阴性对照,PCS 孔、待测样品孔设置为待测样品。
2. 在“实验分析”页面点击![]() , 在“反应孔信息表中”可读取无模板对照 NTC、阴性对照 NCS、阳性对照 PCS、待测样品的检测值。
, 在“反应孔信息表中”可读取无模板对照 NTC、阴性对照 NCS、阳性对照 PCS、待测样品的检测值。
l 以 7500 Real-Time PCR System、软件版本 2.4 为例:
1. 在 Results 的 Amplification Plot 面板中,将 Threshold 设置为 2500; Automatic Baseline:否;Baseline Star Cycle:3,End Cycle:15。点击 Analyze,此时可初步查看扩增曲线的形态是否正常。
2. 在 Results 的 Plate 面板中,将无模板对照 NTC 孔的 Task 一栏设置为NTC,将阴性对照 NCS 孔、待测样品孔、阳性对照 PCS 孔的 Task一栏设置为 Unknown,并且在相应的 Sample Name 一栏中命名为NTC、NCS、S、PCS,之后点击![]() 。
。
3. 在 Results 的 Report 面板中,Mean Quantity 一栏可读取无模板对照NTC、阴性对照 NCS、待测样品、阳性对照 PCS 的检测值。
上述示例结果分析的参数设置仅供参考,具体需依据实验室机型及使用的软件版本进行设定。
使用 Roche LightCycler 480 Ⅱ仪器检测,必须先进行颜色补偿实验,操作方法请咨询湖州申科技术支持。建议使用 SHENTEK-96S 进行多重 qPCR 检测。
结果判断
质控和判定标准应基于仪器和实验室验证数据,可从满足检测限要求考虑。
1. 质控样品 NTC、NCS、PCS 检测结果参考表 5:
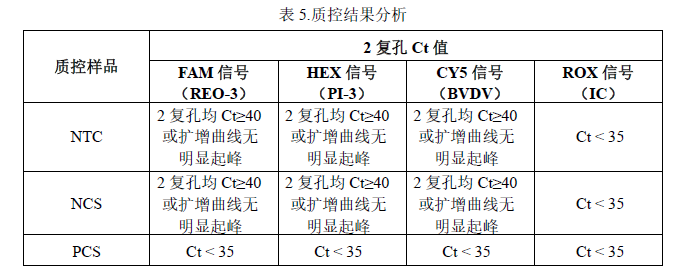
2. 待测样品检测结果判定参考表 6:
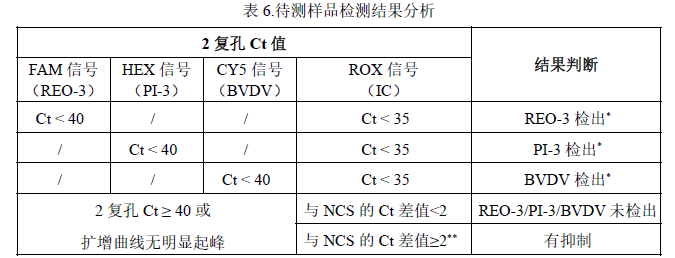
*分析各荧光通道的检测值,可能不止一种病毒存在于样品中,只要 2 复孔有 1 孔以上 Ct< 40 且有效的“S”型扩增可判定样品中存在该病毒核酸。
**计算样品的 ROX 检测 Ct 值与 NCS 的 Ct 值均值差值,大于 2 说明提取检测受到抑制,需重测或对样品进行合适处理消除抑制因子来确定样品是否无病毒检出。
1. 根据所要检测样品数量,计算所需反应孔数,一般做 2 个重复孔/样。反应孔数 =(1 个无模板对照 NTC + 1 个阴性对照样品 NCS +1 个阳性对照样品 PCS + N 个待测样品)× 2
2. MIX 总量计算:根据反应孔数计算本次所需的 qPCR MIX 总量。MIX 总量 =(反应孔数 + 2)× 20 μL(含有 2 孔的损失量)
3. 根据表 7 配制表准备各试剂 qPCR MIX 用量。表 7.多重 qPCR MIX 配制表
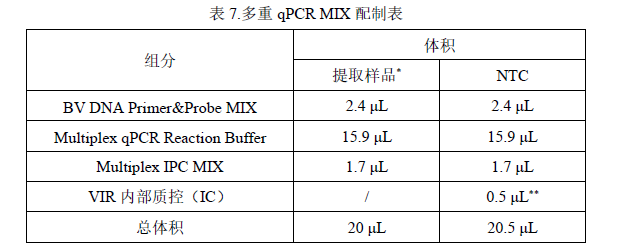
*提取样品包括待测样品,NCS 和 PCS,IC 作为内部质控在提取检测阶段加入到样品中。
**NTC 作为检测时的阴性对照需要配置单独加入 VIR 内部质控(IC)的 MIX进行检测。
1. 将所有待检测溶液振荡混匀后按表 8 和表 9 所示加样:表 8.各反应孔加样示例
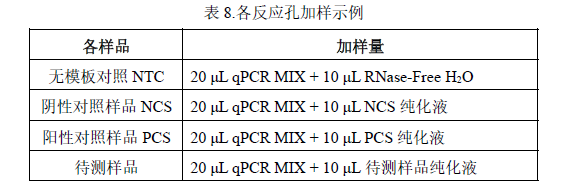
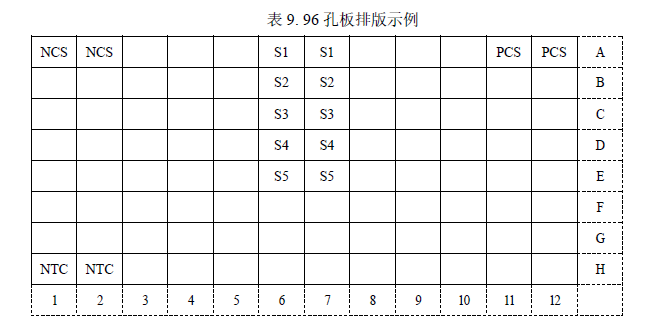
² 该示例表示的是检测 1 个阴性对照样品 NCS、1 个无模板对照 NTC、1个阳性对照样品 PCS、5 个待测样品。每个检测做 2 个重复孔。
² 实际检测时可根据样品多少,参照表 4 示例进行 96 孔板排版加样。
将八联管用配套管盖盖紧或 96 孔板用光学膜封闭,轻微震荡混匀,短时间快速离心 10 秒后放入 qPCR 仪,接着进行 qPCR 程序设置:
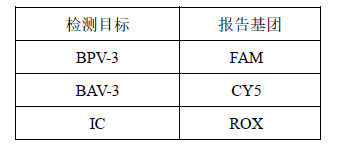
TaqMan 探针报告基团:
l SHENTEK-96S 实时荧光 PCR 检测系统、软件版本 8.2.2 为例:
1. 点击“实验向导”。
2. “孔板编辑”页面中选择步骤 1:选择反应孔。
3. 选择步骤 2:选择项目中的“BPV-3/BAV-3 检测”程序。
4. “实验运行”页面中点击“开始”运行程序。
l 以 7500 Real-Time PCR System、软件版本 2.4 为例:
1. 创建空白新程序,选择绝对定量检测模板。
2. 创建新检测探针,命名为“BPV-3”,选择报告荧光基团为 FAM,猝灭荧光基团为 None;创建新检测探针,命名为“BAV-3”,选择报告荧光基团为 CY5,猝灭荧光基团为 None;创建新检测探针,命名为“IC”,选择报告荧光基团为 ROX,猝灭荧光基团为 None;
3. 检测参比荧光设置为“None”。
4. 设置 qPCR 反应程序:
95 ℃ 预变性 10 分钟;
95 ℃ 15 秒,60 ℃ 1 分钟(读取荧光),40 个循环;
反应体积 30 μL。
l 以 SHENTEK-96S 实时荧光 PCR 检测系统、软件版本 8.2.2 为例:
1. “孔板编辑”页面中步骤 3:定义反应孔,将 NTC 孔的样品类型设置为无模板对照,NCS 孔设置为阴性对照,PCS 孔、待测样品孔设置为待测样品。
2. 在“实验分析”页面点击![]() , 在“反应孔信息表中”可读取无模板对照 NTC、阴性对照 NCS、阳性对照 PCS、待测样品的检测值。
, 在“反应孔信息表中”可读取无模板对照 NTC、阴性对照 NCS、阳性对照 PCS、待测样品的检测值。
l 以 7500 Real-Time PCR System、软件版本 2.4 为例:
1. 在 Results 的 Amplification Plot 面板中,将 Threshold 设置为 10000; Automatic Baseline:否;Baseline Star Cycle:3,End Cycle:15。点击 Analyze,此时可初步查看扩增曲线的形态是否正常。
2. 在 Results 的 Plate 面板中,将无模板对照 NTC 孔的 Task 一栏设置为 NTC,将阴性对照 NCS 孔、待测样品孔、阳性对照 PCS 孔的 Task一栏设置为 Unknown,并且在相应的 Sample Name 一栏中命名为 NTC、NCS、S、PCS,之后点击![]() 。
。
3. 在 Results 的 Report 面板中,Mean Quantity 一栏可读取无模板对照NTC、阴性对照 NCS、待测样品、PCS 的检测值。
上述示例结果分析的参数设置仅供参考,具体需依据实验室机型及使用的软件版本进行设定,一般也可由仪器自动判读。
建议使用 SHENTEK-96S 仪器进行多重 qPCR 检测。使 Roche LightCycler 480 Ⅱ仪器检测,必须先进行颜色补偿实验,操作方法请咨询湖州申科技术支持。
结果判断
质控和判定标准应基于仪器和实验室验证数据,可从满足检测限要求考虑。
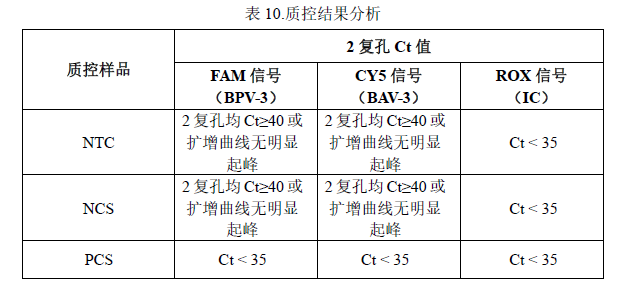
1. 质控样品 NTC、NCS、PCS 检测结果参考表 10:
2. 待测样品检测结果判定参考表 11:
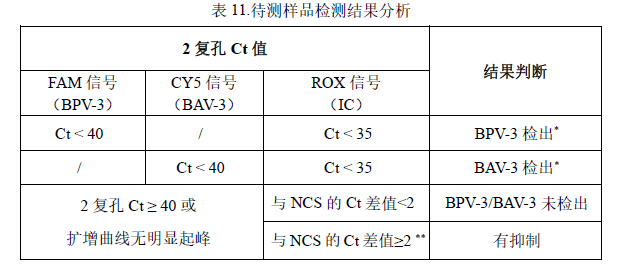
*分析各荧光通道的检测值,可能不止一种病毒存在于样品中,只要 2 复孔有 1 孔以上Ct < 40 且有效的“S”型扩增可判定样品中存在该病毒核酸。
**计算样品的ROX 检测Ct 值与NCS 的Ct 值均值差值,大于 2 说明提取检测受到抑制,需重测或对样品进行合适处理消除抑制因子来确定样品是否无病毒检出。
生效日期:2024 年 10 月 28 日




