

本试剂盒参照《人源干细胞产品药学研究与评价技术指导原则(试行)》和《干细胞制剂质 量控制及临床前研究指导原则(试行)》所述相关内容,可以监测干细胞活性 及生长状况,也可在一定程度用于体外表征细胞的成瘤性。
试剂盒基于端粒重复扩增程序(TRAP)和荧光定量PCR 技术,设计了双重荧光qPCR 反应体系。为闭盖检测,省去了凝胶电泳或ELISA 分析等的繁琐操作,极大地提高了检测效率,同时也降低了待测样品被污染的风险。
SHENTEK®端粒酶活检测试剂盒(Real-time Quantitative TRAP 法,即 RQ-TRAP 法)基于端粒重复扩增程序(TRAP)和荧光定量 PCR 技术,设计了双重荧光 qPCR 反应体 系:一方面,以内参基因评估待测样品中是否存在 PCR 抑制物,排除假阴性的可能;另一方面,以 TSR8 为定量参考品对待测样品的端粒酶活性进行精确定量。从而实现了高 灵敏度、准确定量检测端粒酶活的目的。另外,本试剂盒为闭盖检测,省去了凝胶电泳或 ELISA 分析等的繁琐操作,极大地提高了检测效率,同时也降低了待测样品被污染的风险。
参照《人源干细胞产品药学研究与评价技术指导原则(试行)》和《干细胞制剂质量控制及临床前研究指导原则(试行)》所述相关内容,本试剂盒可以监测干细胞活性及生长状况,也可在一定程度用于体外表征细胞的成瘤性。
该试剂盒仅供研究使用,不可用于诊断。
n 试剂盒组分
表 1.试剂盒组分
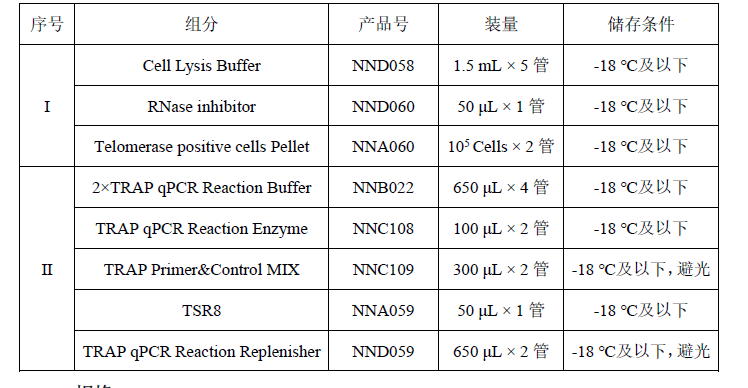
n 规格
n 有效期
规定储存条件下 18 个月,具体详见试剂盒标签。
n 适用机型(包括但不限于)
1. SHENTEK-96S 实时荧光 PCR 检测系统
2. 7500 Real-Time PCR System
3. Roche LightCycler 480 Ⅱ
n 实验所需但试剂盒中未含材料
1. 1.5 mL 无菌无核酸酶低吸附离心管
2. 96 孔 qPCR 板或八联管
3. 1000 μL,200 μL,100 μL,10 μL 无核酸酶低吸附带滤芯枪头
4. PBS (无 Mg2+和 Ca2+, pH=7.4 左右)
n 相关设备
1. 迷你离心机
2. 漩涡振荡器
3. 荧光定量 PCR 仪
4. 1000 μL,200 μL,100 μL,10 μL 移液枪
5. 台式高速冷冻离心机
6. 金属浴或水浴锅
注:实验过程中应注意严格的分区,样品制备区、阳性区、阴性区可在单独一个房间进行划分,扩增间应另外配备 1 个房间,各区域间应避免交叉污染。
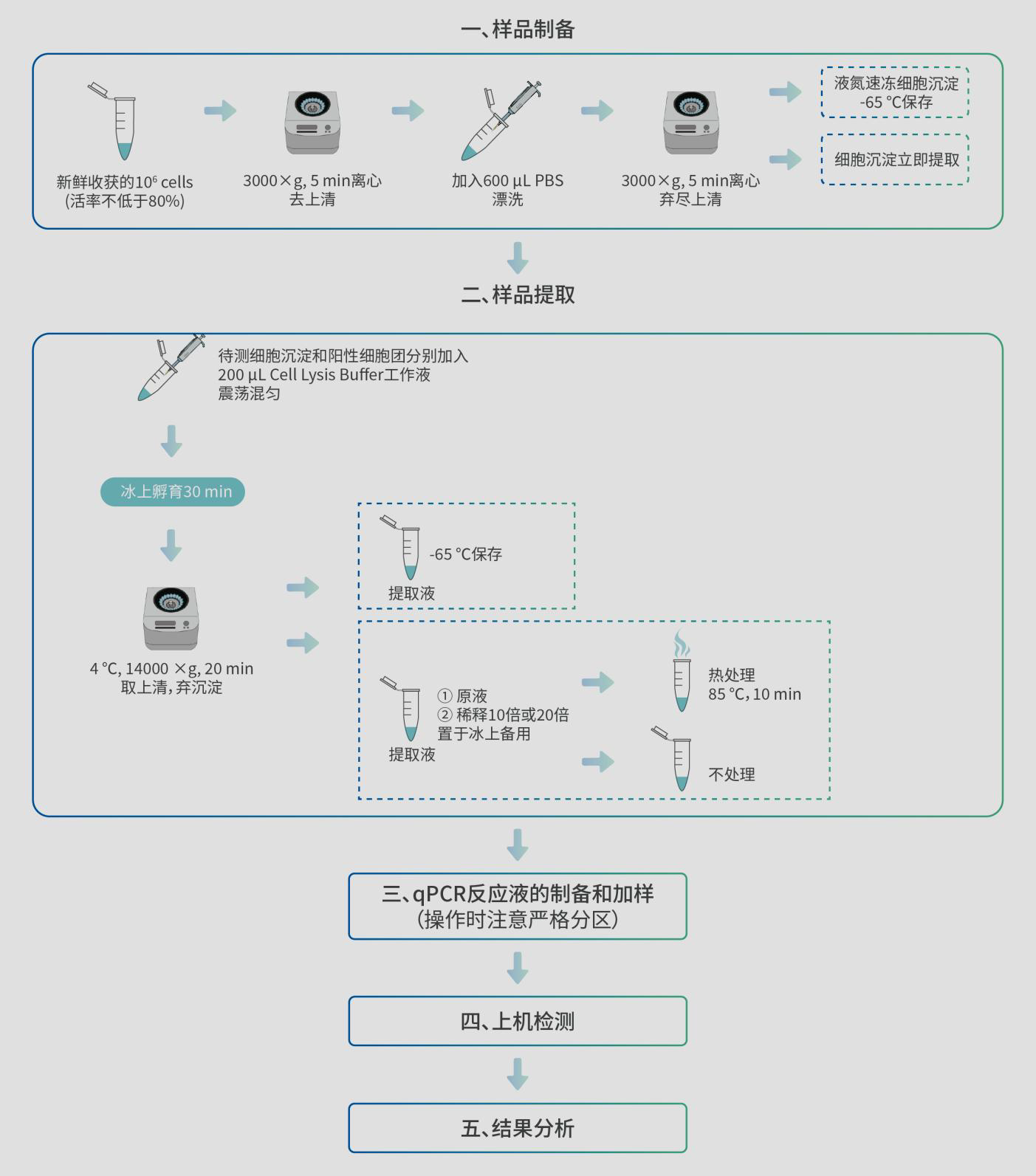
一、样品准备
1. 计算实验所用 Cell Lysis Buffer 工作液的用量总量= 400 μL(标曲配制)+ 200 μL×样品数量(样品提取)+50 μL×样品数量(样品稀释)
2. Cell Lysis Buffer 工作液配制
在阴性区域按照每 1 mL Cell Lysis Buffer+5 μL RNase inhibitor 的配比配制Cell Lysis Buffer 工作液,置于冰上预冷备用。
Ø 注意 Cell Lysis Buffer 工作液要现配现用。
Ø 注意 Cell Lysis Buffer 工作液要在阴性区进行配制,配制完成后置于冰上预冷。
1. 取新鲜收获的 106 个 cells(要求活率不低于 80%),3000×g 离心 5 min,移液枪小心去上清,接着加入 600 μL 左右的 PBS 漂洗细胞。
2. 3000×g 离心 5 min, 移液枪小心去尽上清,保留细胞沉淀。根据实际情况可进行以下操作:
① 情况 1:不能立即进行样品提取,可将细胞沉淀用液氮速冻 30 s 后置于-65 ℃及以下保存,保存时间建议不超过 1 年,不可反复冻融;
② 情况 2:立即进行样品提取,将细胞沉淀置于冰上备用。
Ø 注意此步骤离心后应尽可能去尽上清液,仅保留细胞沉淀。
Ø 注意以上步骤操作均应在样品制备区进行。
1. Telomerase positive cells Pellet 4 ℃条件下 14000×g 离心 1 min,将细胞冻干粉收集至管底。
2. 在待测细胞沉淀和 Telomerase positive cells Pellet 中分别加入 200 μL Cell Lysis Buffer 工作液,漩涡振荡器上轻微涡旋混匀,快速离心 3 s,将液体收集至管底。
Ø 加入 Cell Lysis Buffer 工作液后细胞应呈均匀分布状态,若有肉眼可见的细胞团存在,则需进行震荡混匀至细胞分布均匀。
3. 冰上(4 ℃左右)孵育 30 min, 4 ℃条件下 14000×g 离心 20 min,取 160 μL 左右的上清液作为样品提取液,置于冰上备用。
Ø 注意剩余提取液需尽快置于-65 ℃冰箱保存,建议保存时间不超过 6 个月。
Ø 样品提取液应避免反复冻融,建议将剩余提取液小体积分装保存。
1. 稀释(如需)
取 5 μL 样品提取液+45 μL Cell Lysis Buffer 工作液进行 10 倍的稀释,置于冰上备用。
Ø 因样品中可能存在 PCR 抑制物,故对待测样品提取液是否要稀释作出以下说明:
① 对于端粒酶活性高的样品(如:肿瘤细胞、自发永生化细胞、hiPSC 细胞等),首次测试建议稀释 10 倍后再进行检测,或直接对 105 cells 进行提取检测;
② 对于端粒酶活性低的样品(如:原代细胞、有限细胞系、hMSC 细胞等),首次测试建议提取液直接检测;
③ 对于端粒酶活性未知的样品,首次测试建议提取液进行至少两个浓度的测试:提取原液和稀释 10 倍后的提取液。
以上建议仅供参考,提取液最佳稀释倍数以用户实际经验为主。
Ø 样品提取液应始终置于冰上,以保持端粒酶活性。
Ø Telomerase positive cells Pellet 的提取液不需要稀释直接检测即可。
取 10 μL 待测样品提取原液或稀释后的提取液置于新的 1.5 mL EP 管中,在 85 ℃的金属浴或水浴中热处理 10 min,缓慢冷却至室温后,快速离心
3 s 将液体收集到管底备用。
Ø 目的是通过热处理使得待测样品中的端粒酶失活,以此作为阴性质控确保检测结果的准确性。
Ø 每个待测样品的提取液都需要进行热处理。
1. 各试剂放在冰上或2-8 ℃条件下融化,充分混匀后根据下表所示配制 qPCR MIX:
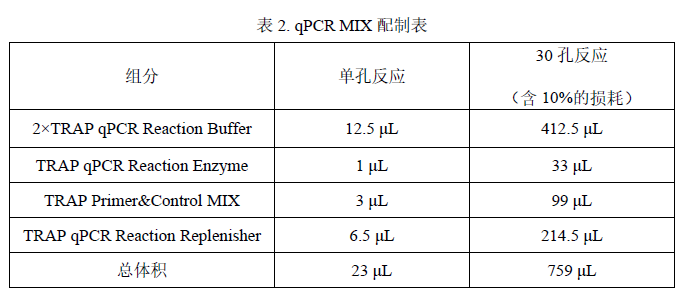
2. 将 qPCR MIX 充分混匀后按照 23 μL/管分装至 8 联管或 96 孔板中,置于冰上备用。
1. 取一支干净的 1.5 mL 离心管,按照 TSR8 的标签标识用 Cell Lysis Buffer工作液将 TSR8 定量参考品稀释至 200 amol/μL,标记为 ST0。
2. 取 6 支干净的 1.5 mL 离心管,分别标记为 ST1,ST2,ST3,ST4,ST5, ST6。
3. 用 Cell Lysis Buffer 工作液,将标记为 ST0 的定量参考品溶液进行 10 倍梯度稀释,具体按下表进行稀释操作:
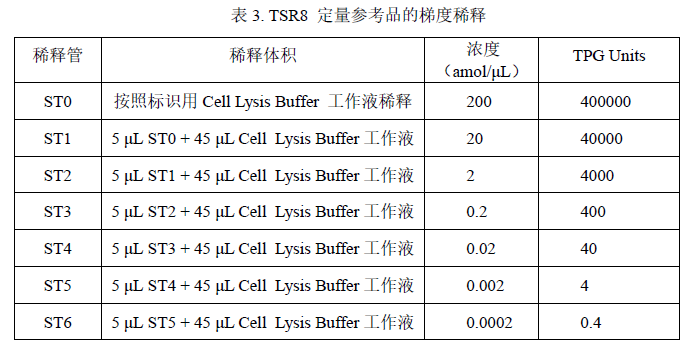
配制好的标曲可保存于 2-8 ℃,仅供当天使用,使用前需将标曲充分混匀。
为保证稀释过程的准确性,建议 TSR8 定量参考品稀释时最小取样量不少于 5 μL。
因标品为 ssDNA, 故应避免标品过度震荡,震荡过程要轻柔。
标准曲线浓度点可根据实际验证结果选择,应至少有 5 个浓度点。
1 amol TSR8=1000 TPG Units
1. 准备好装有 23 μL/管的qPCR MIX 的 8 联管或 96 孔板、样品提取液以及 TSR8定量参考品的稀释管 ST1-ST6 等, 按下表所示分区域进行加样:

Ø 加样完成后每孔总体积为 25 μL。
Ø 加样时注意按照上表进行严格分区,建议加样区域依次为:阴性区、样品制备区、阳性区。
Ø 样品提取液以及 ST1-ST6 使用前建议再次进行混匀操作。
Ø 因模板体积较小以及 Cell Lysis Buffer 工作液略粘稠,故应在加样时注意对枪头的润洗,以确保模板被全部加入。
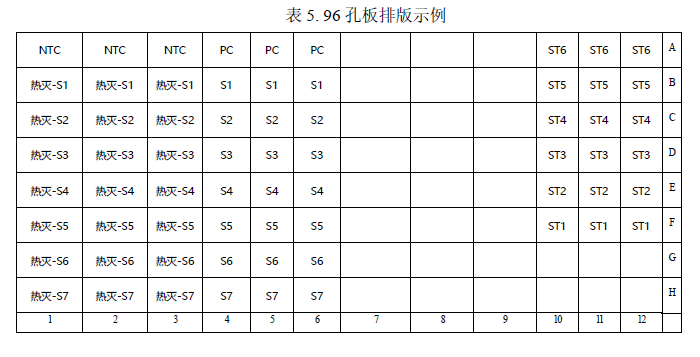
Ø 该示例表示的是检测 6 个浓度梯度的靶标基因的标准曲线(ST1-ST6);无模板对照 NTC;阴性质控:热灭 S1-S7;待测样品: S1-S7 ;阳性质控:PC。建议每个检测做 3 个重复孔。
Ø 实际检测时可根据样品多少,参照表 5 示例进行排版加样。
将 96 孔板用光学膜封闭或 8 联管盖上相应的盖子轻微震荡混匀,短时间快速离心 10
秒后放入 qPCR 仪,接着进行 qPCR 程序设置:
1. 创建空白新程序,选择绝对定量检测模板。创建两组检测探针,分别为靶标基因命名为 Target,选择报告荧光基团为 FAM,猝灭荧光基团为 non(e 如有);;创建内参基因命名为 IC,选择报告荧光基团为 CY5,猝灭荧光基团为 none(如有);检测参比荧光为 ROX(如需)。
2. 设置三步法反应程序:
30 ℃ 30 分钟;
95 ℃ 2 分钟;
95 ℃ 15 秒,50 ℃ 1 分钟,68 ℃ 30 秒(读取荧光),35 个循环;反应体积为 25 μL。
l 以 SHENTEK-96S 实时荧光 PCR 检测系统、软件版本 8.2.2 为例。
在“孔板编辑”页面中选择步骤 1:选择反应孔。
靶标基因 FAM 通道标准曲线孔的样品类型一栏设置为标准品,根据表在属性一栏分别赋值,设为 40000、4000、400、40、4、0.4(含义为每孔的端粒酶活性,单位为 TPG Units),并且在相应的样品名称一栏中命名。将无模板对照 NTC 孔的样品类型设置为无模板对照,将阴性质控孔和待测样品孔的样品类型设置为待测样品,并且在相应的样品名称一栏中命名。
选择步骤 2:选择项目中的“端粒酶活检测”程序。
“实验运行”页面中点击“开始”运行程序。
在实验分析的标准曲线面板中,可读取各标准曲线的斜率、截距、相关系数和扩增效率。
在实验分析的反应孔信息表面板中,浓度和平均浓度一栏可读取无模板对照 NTC、阴性质控、待测样品的检测值,单位为 TPG Units。
l 以 7500 Real-Time PCR System、软件版本 1.4 为例。
在Results 的Amplification Plot 中,将 Threshold 设置为 0.1,点击 Analyze,此时可初步查看扩增曲线的形态是否正常。
在 Results 的 Plate 中,将靶标基因 FAM 通道标准曲线孔的 Task 一栏设置为 Standard,并且在 Quantity 一栏分别进行赋值,设为 40000、4000、400、 40、4、0.4 (含义为每孔的端粒酶活性,单位为 TPG Units),并且在相应的 Sample Name 一栏中命名。
在 Results 的 Plate 中,将无模板对照 NTC 孔的 Task 一栏设置为 NTC,将阴性质控孔和待测样品孔的 Task 一栏设置为 Unknown,并且在相应的 Sample Name 一栏中命名之后点击![]() 。
。
在 Results 的 Standard Curve 中,可读取标准曲线的斜率(Slope)、截距(Intercept)、R2。
在 Results 的 Report 中,Mean Quantity 一栏可读取无模板对照 NTC、阴性质控孔和待测样品孔的检测值,单位为 TPG Units。
上述示例结果分析的参数设置仅供参考,具体需依据实验室机型及使用的软件版本进行设定,一般也可由仪器自动判读。
1. 阳性质控 (Telomerase positive cells):
l 内参基因(CY5):Ct 值与标曲及 NTC 的平均 Ct 值相差不超过 1 个循环;
l 靶标基因(FAM):有检出。
满足以上条件,则视为阳性质控正常。
2. 无模板对照(NTC)和阴性质控(热处理样品):
l 内参基因(CY5):Ct 值与标曲及 NTC 的平均 Ct 值相差不超过 1 个循环;
l 靶标基因(FAM):Ct 值>检测限 。
满足以上条件,则视为阴性对照正常;若出现靶标基因(FAM)的 Ct 值≤检测限,一般表明检测体系存在污染,需要进行原因排查。
3. 标曲的参数:扩增效率应在 83.3% - 110%范围内,R2 ≥0.990。
4. 待测样品(在阳性质控、无模板对照及阴性质控均符合实验要求的前提下):
l 内参基因(CY5):Ct 值与标曲及 NTC 的平均 Ct 值相差不超过 1 个循环,则视为待测样品对反应体系不存在抑制;若 Ct 值超出 1 个循环,则认为该提取液可能对反应体系存在抑制效应,需将样品进行稀释后重新检测。
l 靶标基因(FAM):
待测样品每反应的细胞数量的计算:
细胞数量/reaction=细胞总数/200 μL(细胞裂解液)/稀释倍数(如有)×2 μL(模板体积)
例如:106 个 HEK293 cells 加 200 μL 细胞裂解液后,稀释 10 倍,那么此时待测样品
每反应的细胞数量为 1000 cells,即 1000 cells/reaction。
通过分析软件获得待测样品各检测孔靶标基因(FAM)的检测值
(TPG Units),即可得到待测样品的每反应的细胞数量对应的端粒酶活性。例如:1000 cells/reaction 的 HEK293 cells 靶标基因(FAM)的检测值为 300 TPG Units,那么也就是每 1000 个 HEK293 细胞对应的端粒酶活是 300 TPG Units。




